清华新闻网6月9日电 近日,清华大学药学院张从刚研究员课题组发现人类宿主防御肽LL-37是一种高效的cGAMP转运体,可以通过与cGAMP特异性结合从而双向跨细胞膜转运cGAMP,传播和放大“第二信使”cGAMP携带的免疫信号,进而在靶细胞内激活强烈的STING信号以及干扰素介导的宿主抗病毒免疫。这是迄今为止首次发现人体内溶解性多肽可以跨膜转运免疫递质cGAMP,这一发现揭示了机体抵御病毒感染的独特机制,同时为困扰人类几十年的问题“维生素D究竟如何抗病毒”提供了分子机制方面的新解释,也为疫苗研发和免疫治疗提供了新靶点和新思路。
在哺乳动物天然免疫系统中,来源于肿瘤或微生物的胞质DNA可激活cGAS合成第二信使—2’, 3’-cGAMP1,2(cGAMP)。cGAMP与STING结合使其形成二聚体,招募TBK1,磷酸化并激活IRF3,诱导I型干扰素和其他细胞因子的表达。cGAMP-STING免疫信号通路在机体抗肿瘤和抗感染等过程中发挥着非常重要的作用。
肿瘤细胞和感染细胞中的的cGAMP往往需要转移到“旁观者”细胞中,从而全局性地调动STING介导的干扰素反应和抗肿瘤/抗病毒免疫。此外,免疫治疗中使用的外源cGAMP以及其它一些由细菌产生的环二核苷酸(如3’, 3’-cGAMP)也需穿过细胞膜来激活机体多细胞免疫反应。然而,由于cGAMP带负电且具有高度亲水性,导致其很难自发穿过磷脂双层进入靶细胞内发挥作用。因此,研究cGAMP的跨膜运输对阐明宿主免疫防御机制和改善cGAMP免疫治疗效果都具有极其重要的意义。近年来,科学家逐步发现细胞间gap junction3和细胞膜上阴离子通道蛋白(SLC19A14和LRRC85)可以作为cGAMP的跨膜转运系统。但是,机体内是否存在溶解性的、游离的蛋白或多肽参与cGAMP跨膜转运目前尚不清楚。
该研究团队通过大范围筛选成功鉴定到一条人类细胞中的游离多肽LL-37可协助cGAMP进入细胞。LL-37是Cathelicidin抗菌肽家族的唯一人类成员,具有抗菌、抗病毒、免疫调节、促进伤口愈合等多种生物学功能。研究者发现,在LL-37的协助下,cGAMP能够强烈激活STING信号通路,并诱导大量的IFNβ的产生(图1)。
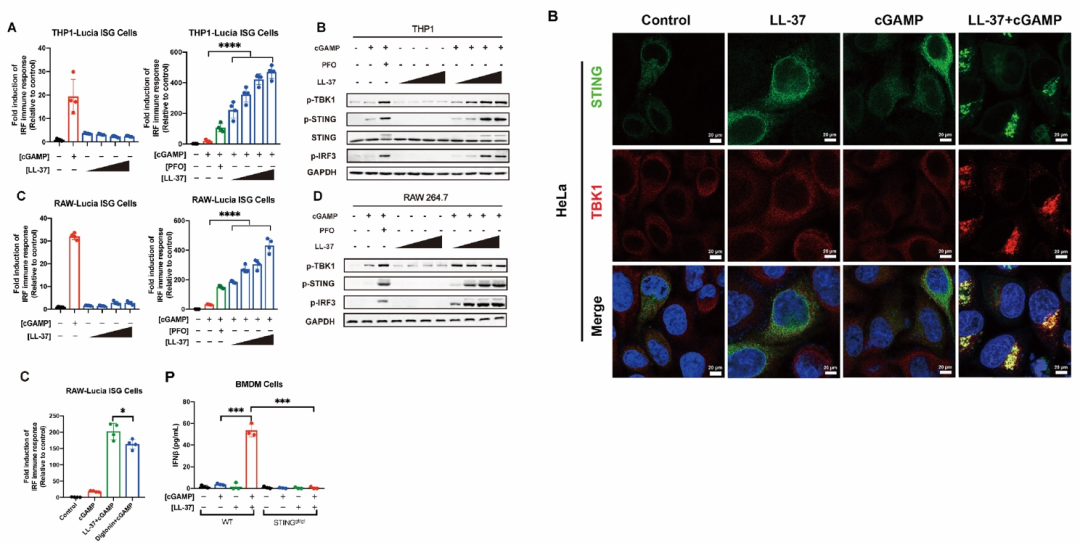
图1. LL-37促进cGAMP强烈激活STING信号通路和干扰素反应
为了进一步探究机体内源性LL-37是否也可以发挥相似的功能,研究者用两种LL-37诱导剂(维生素D [VD3] 和丁酸钠 [SB])诱导内源LL-37的表达。结果表明,VD3和SB都能够显著增强cGAMP介导的STING信号通路的激活。然而,当敲除LL-37基因后,VD3和SB对cGAMP免疫反应的增强作用完全丧失,表明VD3和SB通过诱导内源LL-37表达促进cGAMP介导的STING信号传导(图2)。前人研究表明,人体上皮细胞、唾液以及感染或炎症部位的LL-37浓度可达2-12μg/ml。该研究团队证明,此生理浓度下的LL-37足以有效促进cGAMP诱导的免疫反应,同时强效抑杀G+和G-致病菌。
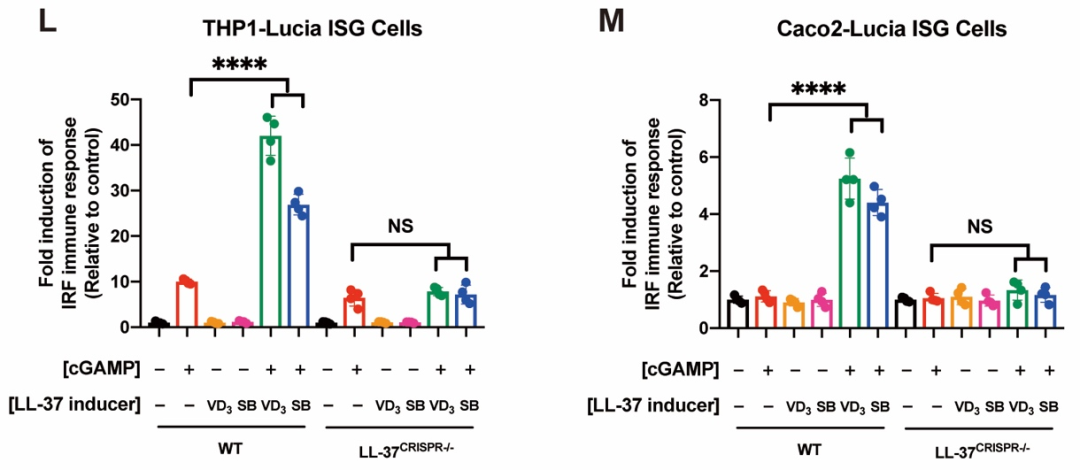
图2. VD3和SB通过诱导内源LL-37表达促进cGAMP介导的STING信号激活
接着,该研究团队通过精妙的细胞间cGAMP转移试验以及ITC、MST等试验发现LL-37通过与cGAMP特异性结合从而对cGAMP进行跨细胞膜运输(图3)。
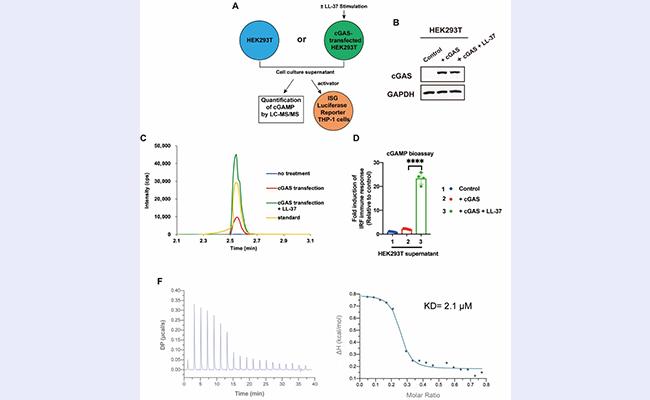
图3. LL-37通过与cGAMP特异性结合双向跨膜转运cGAMP
此外,该研究团队发现LL-37显著增强了cGAMP介导的宿主抗病毒免疫。研究者发现LL-37强烈促进了cGAMP诱导的ISG相关基因的表达(图4F)。此外,LL-37-cGAMP明显增加了小鼠血清中的IFNβ和CXCL10水平(图4G)。与单独使用cGAMP或LL-37相比,cGAMP-LL-37能够更好地缓解HSV-1诱导的小鼠体重下降症状(图4C)。更重要的是,LL-37-cGAMP组合几乎完全消除了THP1细胞(图4A和4B)和小鼠脾脏(图4D和4E)中的病毒感染。
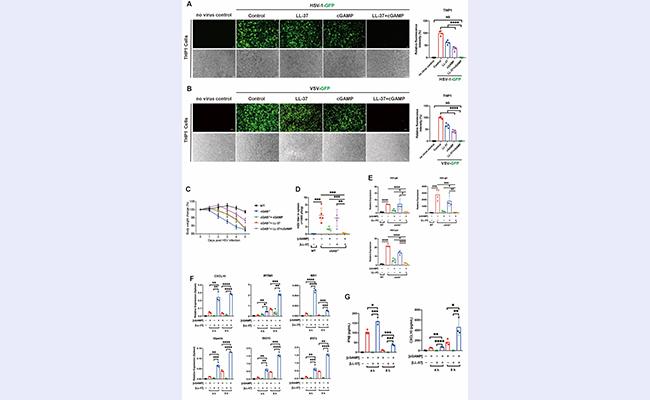
图4.LL-37-cGAMP可以强烈激活宿主抗病毒免疫
研究表明补充VD3可以增强基于IFNβ的抗病毒反应,并有证据显示补充VD3甚至可以缓解SARS-CoV-2诱发的急性呼吸道综合征。尽管早有研究报道VD3能够诱导内源性LL-37的产生,但尚不清楚VD3诱导的LL-37表达与IFNβ介导的抗病毒反应之间是否存在联系。该研究证明,VD3通过诱导内源LL-37的表达,促进了cGAMP的跨膜转运,从而高效激活STING信号通路并促进IFNβ介导的抗病毒免疫反应,解开了这个困扰人类几十年的谜题。
综之,该研究首次发现人类宿主防御肽LL-37可作为cGAMP的转运体高效激活STING介导的先天免疫反应(图5),为机体免疫调节和抗感染机制提供新的见解,并为临床免疫治疗提供了新思路。
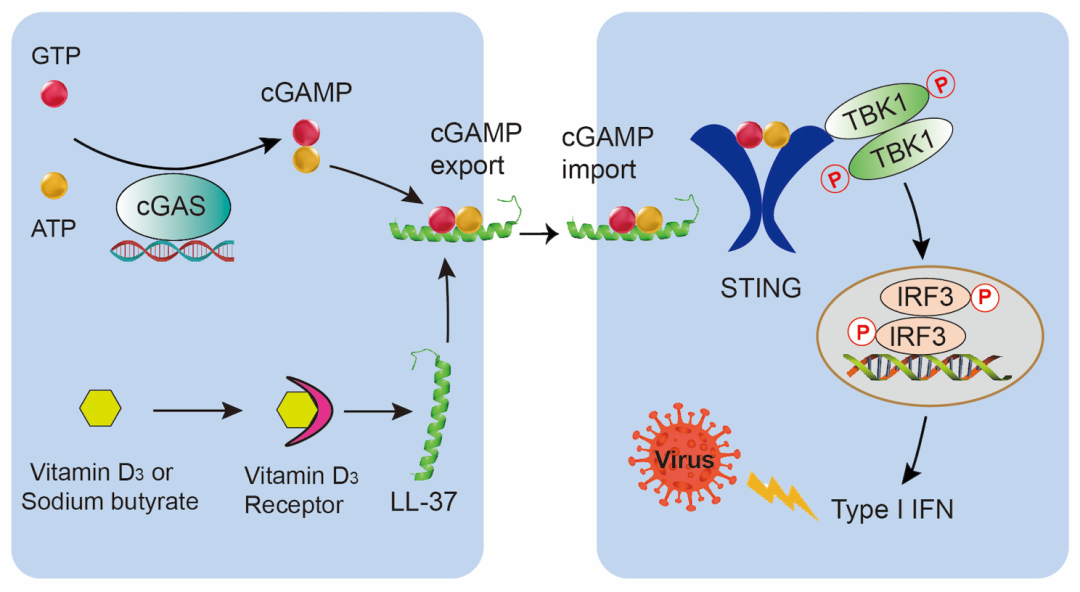
图5. LL-37跨膜转运cGAMP以激活STING信号通路并增强IFN介导的宿主抗病毒免疫的示意图
上述研究于5月31日在《细胞报道》(Cell Reports)期刊发表,标题为“LL-37转运cGAMP激活STING信号,增强干扰素介导的宿主抗病毒免疫”(LL-37 transports immunoreactive cGAMP to activate STING signaling and enhance interferon-mediated host antiviral immunity)。
清华大学药学院张从刚研究员和上海交通大学基础医学院孙序序研究员为该论文通讯作者,张从刚课题组博士后卫旭彪和张璐璐为该论文第一作者。该研究得到了国家自然科学基金项目、清华-北大生命科学联合中心、中国博士后科学基金以及上海东方学者基金的资助。
论文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(22)00655-6
供稿:药学院
编辑:李华山
审核:吕婷