清华新闻网7月9日电 近日,清华大学药学院王钊课题组系统总结了碳水化合物的发展历史、分类及体内代谢过程;通过对以往发表文献数据进行整理分析,得到淀粉类碳水化合物与机体炎症水平具有直接相关性;归纳总结了诱发肝脏炎症的关键因子以及相关通路;提出mTORC1调控碳水化合物导致的炎症以及脂质堆积的可能性,并对碳水化合物影响肝脏脂质代谢的未来研究方向进行了讨论和展望。
脂肪肝是以肝内脂质堆积为特点的肝脏脂代谢异常疾病,影响着全球超过四分之一的人口,在我国更是达到了近30%的患病率,是当前最为严重的公共健康问题之一。饮食调整是目前公认的缓解脂肪肝最经济、有效的方法。在过去,过量高脂饮食的摄入被认为是导致脂肪肝的主要原因。然而,近年来,多项人群研究显示,碳水化合物,尤其是游离糖的摄入,在诱发脂肪肝并导致其进一步恶化中扮演着重要角色。加之碳水化合物作为日常主食的主要成分,所带来的影响是持续性的。
然而,对于淀粉类碳水化合物对脂肪肝的影响,以及碳水化合物调控肝脏脂质代谢的机制并没有系统阐述。团队通过在PubMed, Clinicalkey, Web of Science, 以及Scopus数据库中检索相关报道,选取血浆中谷丙转氨酶(ALT)、谷草转氨酶(AST)代表炎症水平,血浆中甘油三酯(TG)、总胆固醇(TC)代表脂质水平,并将碳水化合物分为总碳水化合物、游离糖、淀粉类碳水化合物,分别进行相关性分析。相关性分析显示,淀粉类碳水化合物与炎症指标AST、ALT呈正相关关系,游离糖与AST呈正相关关系,与ALT无相关性,且淀粉类碳水化合物与AST表现为较游离糖更高的关联性。无论是总碳水化合物、游离糖还是淀粉类碳水化合物,均与脂质指标TG、TC无相关性。TG与炎症指标AST、ALT呈正相关关系。
结合以往报道以及课题组前期研究,表明高碳水化合物摄入会加重肝内脂质堆积以及全身炎症,提示碳水化合物通过炎症发挥对肝脏脂质调控功能的可能性。
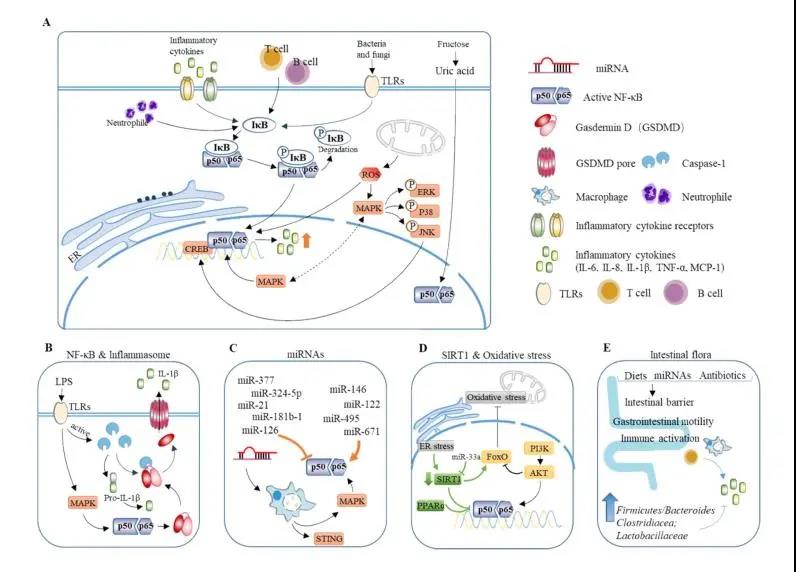
图1.导致肝脏炎症的主要通路以及调控因子
NF-κB作为重要的核转录因子,在机体炎症反应、免疫应答等方面发挥重要作用,同时也是当前研究中报道最多的诱导肝脏炎症的因子。当细胞受到刺激后,IκB激酶被磷酸化/泛素化降解,释放NF-κB二聚体,使NF-κB转移入核,通过与靶基因启动子结合,促进下游炎症因子的转录和表达,从而引起肝脏炎症。
当前报道如PARP-1/PPARα/SIRT1通路、MAPK通路、TLR4信号通路等都是通过激活NF-κB或者协同NF-κB诱发肝脏炎症。高果糖诱发的肝内炎症同样是由于尿酸水平升高, NF-κB激活所致;同样,PI3K-AKT通路也被报道能够调控NF-κB表达。除此之外,活性氧,miRNAs、内质网应激等,通过影响MAPK、巨噬细胞、SIRT1等影响炎症因子的表达和释放。此外,肠道菌群通过重塑肠道微环境,改变肠道通透性,影响肠道代谢物,参与机体免疫、调控炎症发生以及炎症因子的释放。另外,其他组织器官的紊乱同样会影响肝脏的炎症水平,例如脂肪组织受损后,分泌的大量脂肪酸和炎症因子可以经由血液循环传递至肝脏,从而造成炎症损伤。
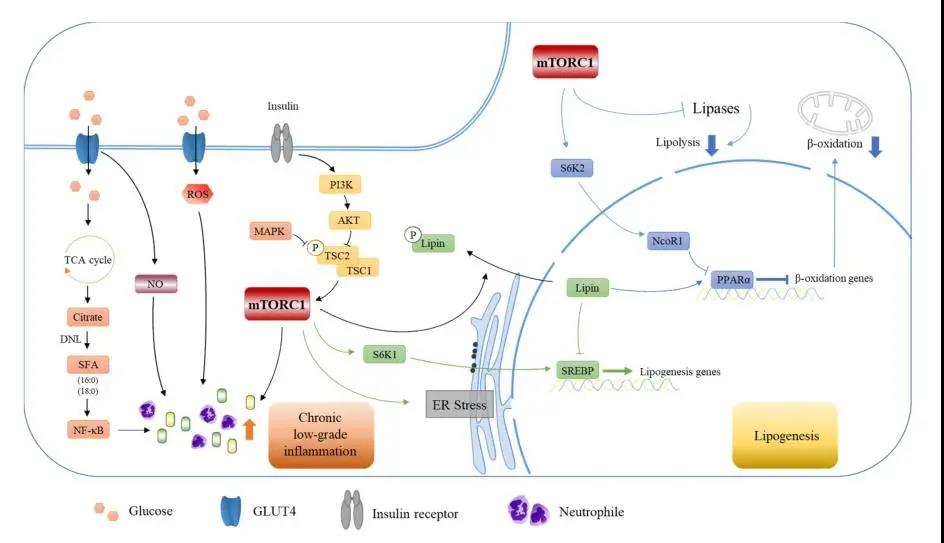
图2. 高碳水化合物通过mtorc1通路导致炎症并进一步调控脂质产生
综合当前研究以及研究组整理分析得到的结论,碳水化合物主要通过NF-κB和mTORC1通路诱发炎症。碳水化合物在肠道被消化成单糖并通过GLUT4进入细胞,经过TCA循环代谢为柠檬酸盐,而后通过脂质从头合成途径合成脂肪酸并激活NF-κB,诱导生成大量炎症细胞因子。此外,碳水化合物通过影响细胞内ROS和NO水平,进一步诱导炎症因子释放。
同时,PI3K/AKT激活的mTORC1通路也可导致肝内炎症水平和中性粒细胞含量增加,以此共同导致肝内的炎症水平提升。此外,mTORC1通过S6K1和SK62影响核内脂质合成相关基因SREBP和PPARα的转录,从而促进脂质合成,抑制脂肪酸氧化,导致肝脏脂质沉积和脂肪肝的形成。
本文就生活中最常见、易摄入的营养物质,碳水化合物,尤其是淀粉类碳水化合物对脂肪肝的影响进行了详细的论述,通过从近7000篇文献中筛选合适的临床数据,分析得到碳水化合物与炎症之间具有显著正相关性,并提出碳水化合物以间接方式干预肝内脂质含量的推论。根据目前研究报道,提出mTORC1在调控碳水化合物导致的脂肪肝中的可能作用,为今后糖脂代谢的研究提供新的思路。
以上综述论文在线发表在营养学国际知名学术期刊《营养研究评论》(Nutrition Research Reviews),论文题目为“碳水化合物通过激活炎症反应恶化脂肪肝”(Carbohydrates deteriorate fatty liver by activating the inflammatory response)。
清华大学药学院王钊教授为本文通讯作者,王钊组博士生高钰琪为本文第一作者。实验室成员花瑞、胡凯强共同参与本文工作。本研究得到了国家自然科学基金、国家科技部重点研发计划、海外重点研发计划、清华大学结构生物学高精尖创新中心的支持与资助。
论文链接:
https://www.doi.org/10.1017/S0954422421000202
供稿:药学院
编辑:李华山
审核:吕婷