清华新闻网10月6日电 近期,清华大学药学院唐海东课题组针对树突状细胞的PD-L1分子削弱T细胞活化并调控免疫检查点阻断治疗的应答开展研究并取得成果,成功揭示了树突状细胞上PD-L1分子在T细胞活化与肿瘤免疫治疗中的关键作用。
近年来,肿瘤免疫疗法取得了突破性的进展,并在临床上得到了广泛应用。然而,目前仅有小部分患者能够从中获益。因此,相关的机制研究对于改进当前的疗法、从而使更多的患者从中受益具有重要意义。PD-1/PD-L1是重要的免疫检查点分子。在正常情况下,PD-L1可以与T细胞上的PD-1结合,抑制T细胞的活化,从而避免自身免疫疾病的产生。很多肿瘤通过高表达PD-L1来抑制T细胞反应,从而逃逸免疫杀伤。在肿瘤患者中,利用PD-1/PD-L1阻断性抗体治疗后,T细胞的活化可以被显著增强。然而,目前关于PD-1/PD-L1阻断治疗介导T细胞活化的机制尚未完全清楚。此外,对于被治疗所激活的T细胞,它们的来源也还存在争议。带着这些疑问,课题组进行了相关研究工作。
在肿瘤微环境中,除了肿瘤细胞,很多免疫细胞也会表达高水平的PD-L1。然而受限于研究模型,肿瘤细胞以外的PD-L1究竟发挥了何种功能尚不清楚。课题组的研究首先发现肿瘤微环境中树突状细胞表达的PD-L1远高于肿瘤细胞。为了研究不同细胞上PD-L1的功能,课题组构建了新的小鼠动物模型,在树突状细胞上特异地敲除PD-L1。当树突状细胞PD-L1被敲除后,PD-L1阻断治疗的效果完全消失了。这些结果说明,树突状细胞的PD-L1在肿瘤免疫中起到了关键的作用。抗肿瘤免疫反应中介导T细胞活化的树突状细胞主要包括两个亚群,cDC1与cDC2。进一步的研究发现,PD-L1在两个亚群中的表达模式并不相同。cDC2持续表达了高水平的PD-L1。相比之下,cDC1的PD-L1水平在正常情况下并不高,但在荷有肿瘤的小鼠中会被显著上调。有趣的是,这一上调过程是在DC吞噬肿瘤抗原并介导抗原递呈的过程中,由T细胞分泌的干扰素-g所导致的。
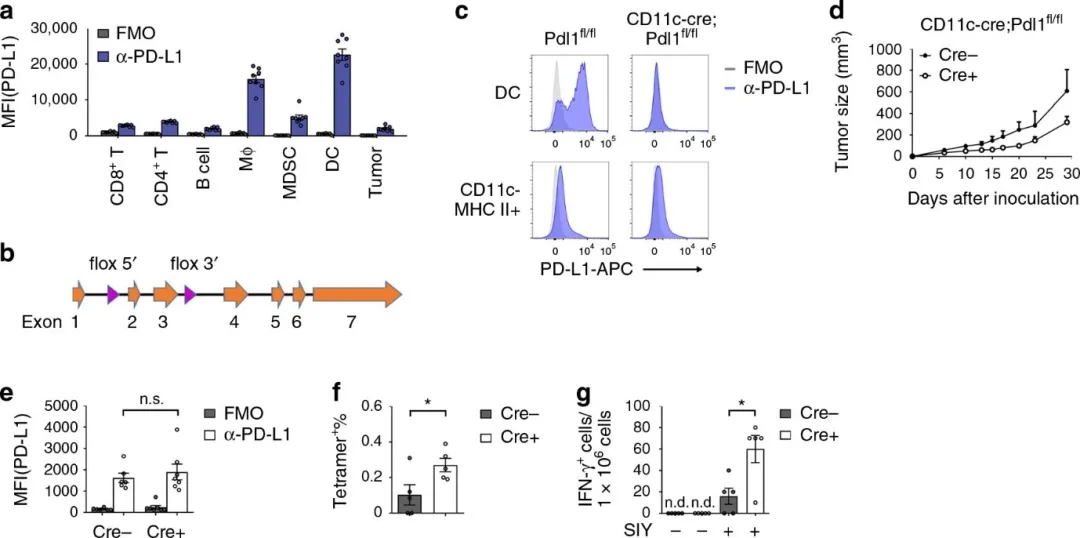
特异性敲除树突状细胞的PD-L1分子可以显著增强抗肿瘤免疫反应
免疫治疗中,被活化的T细胞可能来自于肿瘤以外的外周循环,也可能来自原本就位于肿瘤内的肿瘤浸润T细胞(TIL)。目前,临床上对于免疫治疗后产生的肿瘤特异性T细胞的来源还存在争议。在部分肿瘤中,人们发现被活化的T细胞主要来自于肿瘤外部;而在另一些肿瘤中,已有的肿瘤浸润T细胞足以介导肿瘤的清除。通过在不同时间点阻断T细胞向肿瘤组织的浸润,课题组发现在肿瘤发展的早期,活化的T细胞主要来自肿瘤以外;而在晚期肿瘤中,被活化的T细胞更多来自于肿瘤内部。这些结果为临床上看似互相矛盾的数据提供了一种潜在的解释:在肿瘤细胞大量死亡、或者免疫原性较高的患者中,免疫治疗依赖于肿瘤内与肿瘤外的T细胞;而在免疫原性较低的、或者功能性T细胞较少的患者中,免疫治疗的效果主要依赖于肿瘤内T细胞的再激活。总之,该研究揭示了树突状细胞上PD-L1在T细胞活化中的重要功能,有助于进一步理解临床上广泛使用的肿瘤免疫疗法的作用机制。
以上研究于2020年9月24日发表在《自然通讯》(Nature Communications)杂志上,题为“树突状细胞的PD-L1分子削弱T细胞活化并调控免疫检查点阻断治疗的应答”(PD-L1 on dendritic cells attenuates T cell activation and regulates response to immune checkpoint blockade)。

清华大学药学院研究员唐海东为本文通讯作者,PTN项目博士研究生彭琦为本文第一作者。此外,唐海东课题组研究生张丝琳、张园园,科研助理张孜涵也参与了部分工作。本研究得到了清华大学-北京大学生命科学联合中心、佛山-清华产学研合作协同创新专项(佛山创新专项)等资金的资助。
论文链接:
https://www.nature.com/articles/s41467-020-18570-x
供稿:药学院
编辑:李华山
审核:程曦