清华新闻网2月6日电 为了拥有灵活的智能,大脑不仅需要“记住”,也需要“遗忘”。长期以来,神经科学领域主要关注记忆是如何被编码和存储的。特定的一群被称作记忆印迹细胞(engram cells,通常以即刻早期基因Fos标记)的神经元群体的重激活,被认为是记忆提取的基础。然而,生物学记忆并非一成不变的机械记录,而是能够根据环境变化灵活调整的动态过程。主动遗忘(Active Forgetting)作为记忆灵活性的一种重要形式,不仅是清除冗余信息的过程,更是大脑进行情绪调节和认知更新的关键。虽然已有研究表明海马体Rac1活性在主动遗忘中扮演关键角色,但一个核心的问题始终悬而未决:在大脑的细胞层面,是否存在一个专门负责“遗忘”的实体印迹?遗忘究竟是记忆印迹的消亡,还是被另一种力量所抑制?
2月3日,清华大学生命科学学院、清华-IDG麦戈文脑科学研究院钟毅教授课题组在《神经元》(Neuron)上在线发表了题为“齿状回中介导记忆遗忘的印迹细胞集群的鉴定”(Identification of an engram ensemble mediating memory forgetting in the dentate gyrus)的研究论文。该研究提出了海马体的“双印迹”记忆编码模型:经典的Fos印迹细胞负责记忆的提取,而依赖于另一个即刻早期基因Npas4的NRAM印迹细胞则负责介导遗忘。这一发现颠覆了记忆存储的单一印迹观点,揭示了记忆稳定性和灵活性的双重编码机制,并为阿尔茨海默病和自闭症的认知障碍机制研究提供了全新视角。
研究人员首先关注了小鼠的单次电击情境恐惧记忆(one-shock CFC)和新物体位置记忆(NOL),这类记忆通常会随时间发生自然遗忘。利用Fos-TRAP2系统和Npas4-NRAM报告系统,研究团队在海马齿状回中分别标记了学习过程中激活的Fos阳性神经元群(记忆印迹)和Npas4阳性神经元群(遗忘印迹)。有趣的是,随着记忆的自然遗忘,负责记忆提取的Fos印迹细胞群的重激活水平显著下降,而与此同时,Npas4印迹细胞群的重激活水平却显著上升。这种此消彼长的现象暗示了Npas4印迹细胞群可能在遗忘过程中扮演着主动抑制者的角色。
为了验证这一因果关系,研究人员利用化学遗传学手段对这两群神经元进行了双向操控。结果表明:如果在记忆测试时抑制“遗忘印迹”(NRAM ensemble)的活性,原本已经遗忘的记忆可以重新提取;反之,如果在记忆清晰时人为激活这个遗忘印迹,小鼠的记忆提取表现会显著降低。进一步的实验表明,操纵遗忘印迹的活性,能够直接反向调节“记忆印迹”(Fos ensemble)的重激活水平。这说明,遗忘并不是记忆痕迹的物理抹除,而是通过激活这一特定的遗忘印迹细胞群,对记忆印迹进行了功能性的抑制。
那么,是什么分子机制在调控这一过程?研究团队发现,Rac1这一著名的遗忘调控分子主要在NRAM印迹细胞中发挥作用。利用光激活型Rac1(paRac1)在NRAM印迹细胞中特异性激活Rac1足以诱导记忆遗忘。这表明大脑通过调控遗忘印迹中的Rac1活性,像开关一样灵活地决定是提取记忆还是表现为遗忘。
这一全新的双印迹模型不仅解释了正常生理条件下的记忆灵活性,更深刻揭示了认知障碍疾病的病理机制(图1)。
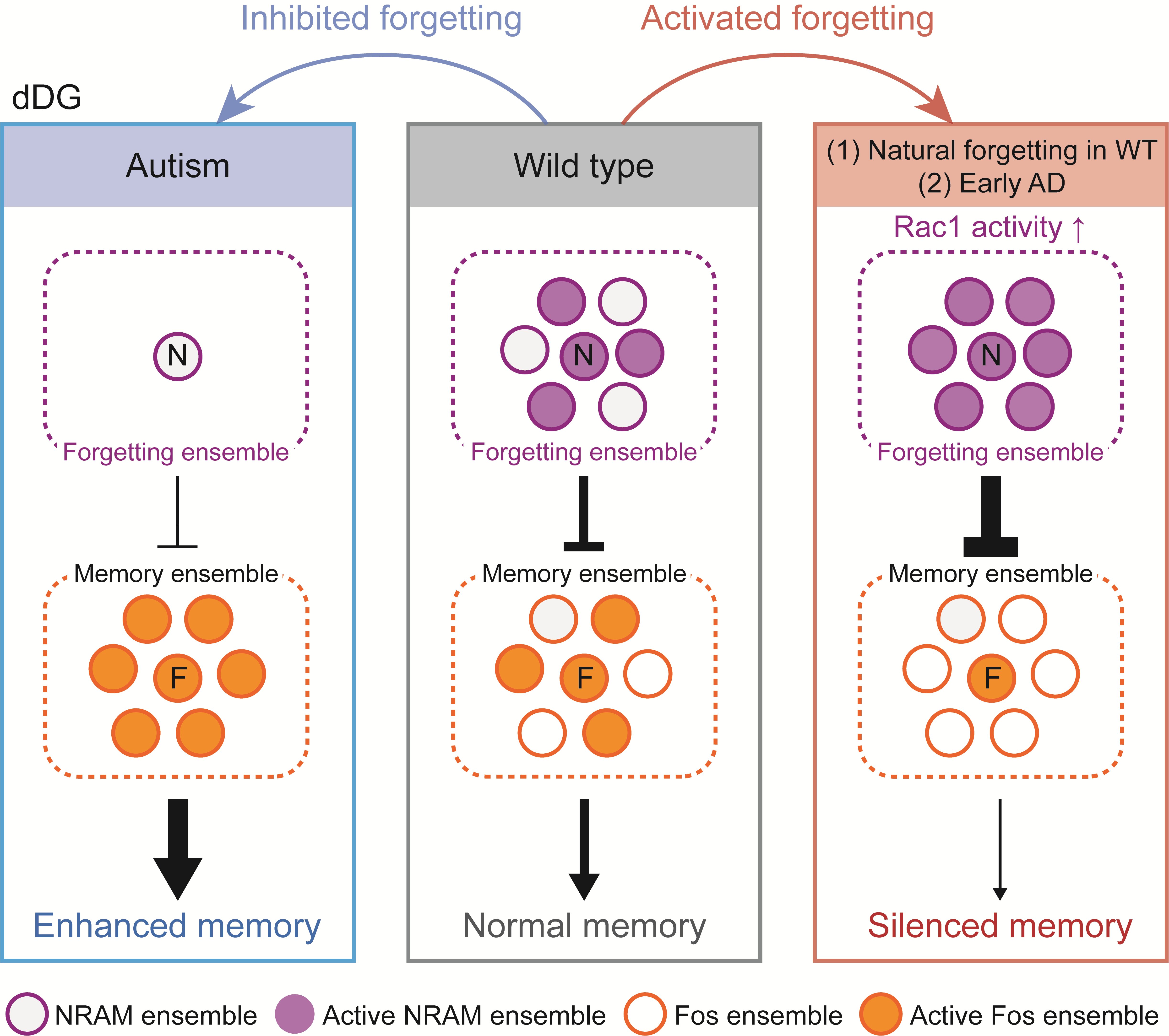
图1 .“双印迹”记忆编码与提取模型
研究团队在阿尔茨海默病(AD)模型小鼠中发现,早期出现的记忆丢失并非源于记忆编码的失败,而是遗忘印迹细胞的过度活跃。抑制AD小鼠海马中的遗忘印迹细胞群,能够恢复其记忆表现。
与之形成鲜明对比的是,自闭症模型小鼠(Shank3 KO)的情景恐惧记忆表现出无法遗忘的特性。进一步研究表明,Shank3 的缺失导致神经元无法在学习时诱导Npas4基因的表达,从而无法形成遗忘印迹。这种遗忘机制的缺失,很可能是自闭症患者表现出认知刻板、行为僵化的神经生物学基础。
综上所述,该研究确立了一个全新的记忆组织模型:在海马体中,记忆的存储与遗忘分别由两群功能正交的神经元群体编码。这一发现将主动遗忘从分子水平推进到了细胞水平,指出遗忘印迹可能是神经疾病(如阿尔茨海默病和自闭症)中更关键的认知障碍相关靶点。
此外,这种记忆与遗忘的“正交编码”机制,也为新一代人工智能系统的设计提供了生物学灵感。通过引入专门的遗忘单元来管理冗余信息或抑制过时策略,有望显著增强人工神经网络在动态环境中的适应能力和持续学习能力。
生命学院2025届博士生胡世强为本文的第一作者,钟毅为本文的通讯作者。清华大学生命学院2024届本科生杨健藩、2022级本科生尹思琪,北京协和医学院基础学院2022级本科生钟艺婕,首都师范大学燕都学院2023级本科生安彦尊,清华大学生命学院2022级博士生郭羽扬、2021级博士生翟紫含为本研究做出了重要贡献。本研究感谢清华大学郭增才副教授、空军军医大学武胜昔教授、王文挺教授分享的小鼠品系,感谢中山大学医学院李乾副教授提供的帮助与建议。
本研究得到了科技创新2030-“脑科学与类脑研究”重大项目(STI2030-Major Projects,2022ZD0204900)、国家自然科学基金委创新群体项目(32021002)、清华-北大生命科学联合中心、北京大学-清华大学-北京生命科学研究所联合研究生项目以及清华-IDG/麦戈文脑科学研究院等资助。
相关论文链接:
https://doi.org/10.1016/j.neuron.2025.12.031
供稿:生命学院
编辑:贠尔茹
审核:黄思南