清华新闻网12月18日电 卵母细胞是哺乳动物体内最大的细胞,其独特的生长模式依赖于发育过程中染色质转录大量的mRNA以合成大量的蛋白质。生长期卵母细胞的染色质呈现非包绕核仁(non-surrounded nucleolus,NSN)的构象:染色质弥散且相对均匀分布在细胞核内,具有高转录活性。随着卵母细胞完成生长,其染色质会变得紧凑并转变成包绕核仁(surrounded nucleolus,SN)的构象,该过程伴随着转录沉默的发生。自上世纪七十年代初科学家首次观察到卵母细胞具有这两种染色质构象后(图1),已有一系列的研究证明SN型卵母细胞的发育潜能比NSN型的高,并尝试通过多组学技术比较发现其中的分子差异。然而,干预这些过往被报道的差异分子并不能在卵母细胞里实现染色质构象的实时转换,因此NSN向SN转变如何发生这一关键问题亟待阐明。
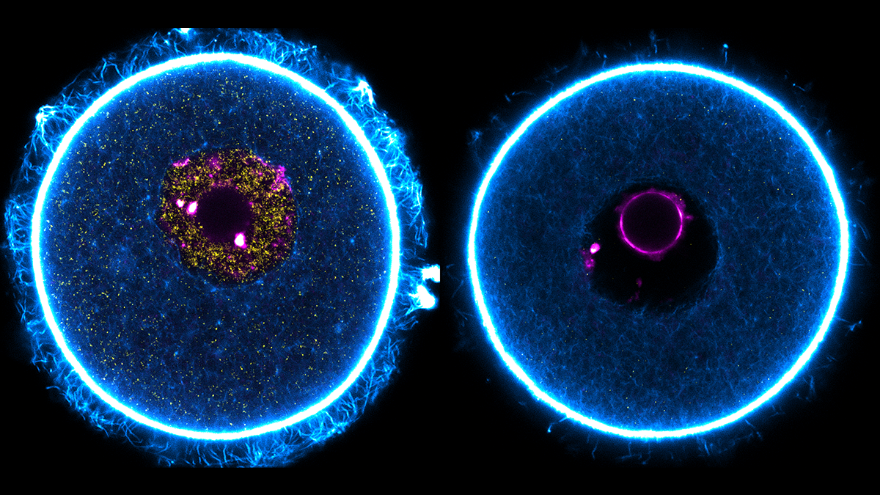
图1. 哺乳动物卵母细胞的两种染色质构象
12月12日,清华大学生物医学交叉研究院苏俊实验室在《自然·通讯》(Nature Communications)发表了题为“RNA聚合酶II的自然降解对于卵母细胞染色质重组和母体到合子的转变是必不可少的”(Natural degradation of RNA polymerase II is essential for oocyte chromatin reorganization and maternal-to-zygotic transition)的研究论文。研究发现发育过程中RNA聚合酶II的自然降解是卵母细胞染色质从NSN转变成SN构象的关键驱动因素。
通过分选不同染色质构象的卵母细胞并进行高分辨成像,研究人员首先系统比较了NSN型和SN型卵母细胞中大概30种不同核蛋白的染色强度与分布,发现大多数核蛋白在SN型卵母细胞里被下调。为筛选能驱动NSN向SN转变的关键核蛋白,研究人员采用小分子抑制剂与mRNA过表达的手段来模拟NSN向SN转变过程中不同蛋白的变化,意外发现一种名为放线菌素D(ActD)的化学小分子可以瞬时诱导NSN向SN转变。
ActD是一种DNA嵌入剂,可以同时抑制RNA聚合酶I和II。利用特异的RNA聚合酶I和II抑制剂,研究人员发现只有RNA聚合酶II(RNAPII)的抑制剂α-鹅膏蕈碱(α-amanitin)和雷公藤内酯(triptolide)可以诱导NSN向SN转变(图2)。通过进一步的表观遗传、高通量染色质构象捕获和卵子发育潜能等测试,确认了经α-amanitin诱导出来的和自然的SN型卵母细胞高度相似。RNAPII是mRNA转录的关键酶。为了明确NSN向SN转变是否直接由转录沉默所介导,研究人员采用了另一类RNAPII抑制剂核苷类似物直接终止其转录活动。有趣的是,核苷类似物可以有效地抑制转录但未能诱导NSN向SN转变,说明α-amanitin和triptolide经其他途径介导NSN向SN转变。经过一系列的排查,研究人员最终发现α-amanitin和triptolide实际上并不直接抑制转录,而是通过降解RNAPII而发挥其作用。
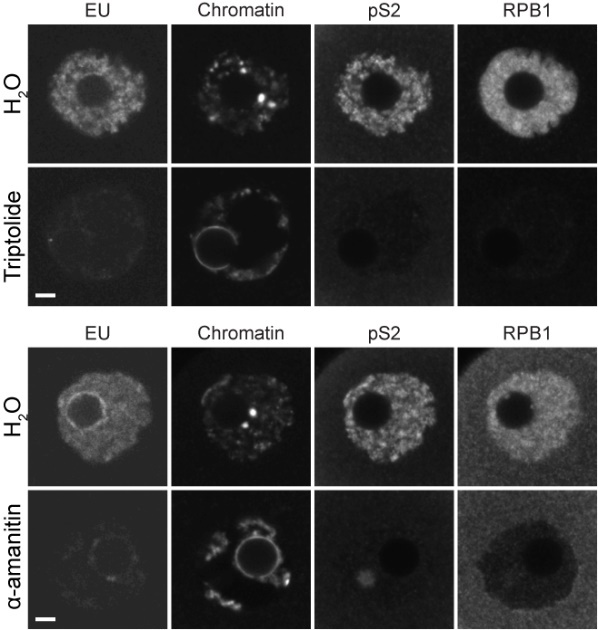
图2. RNAPII抑制剂能体外诱导卵母细胞染色质的NSN向SN转变
要证明NSN向SN转变与内源RNAPII的蛋白水平相关,需要在卵母细胞里敲除或敲降RNAPII。可是RNAPII是细胞里的必需基因,无法通过遗传学手段获得RNAPII敲除的卵母细胞。为此,研究人员革新了2017年发表的Trim-Away急性蛋白去除技术,通过把单链抗体与Trim21 E3泛素化酶的RING结构域融合开发出了miniTrim-Away技术,克服了原技术不能靶向长期滞留在核内的蛋白的痛点。通过RNAPII的miniTrim-Away,研究人员成功在小鼠和人卵母细胞里瞬时降解内源RNAPII并确立其降解驱动NSN向SN转变(图3)。进一步的体内实验亦发现NSN向SN转变与RNAPII的天然降解有关,利用解折叠酶和蛋白酶体抑制剂可以在离体卵泡培养模型中阻止NSN向SN转变的发生。
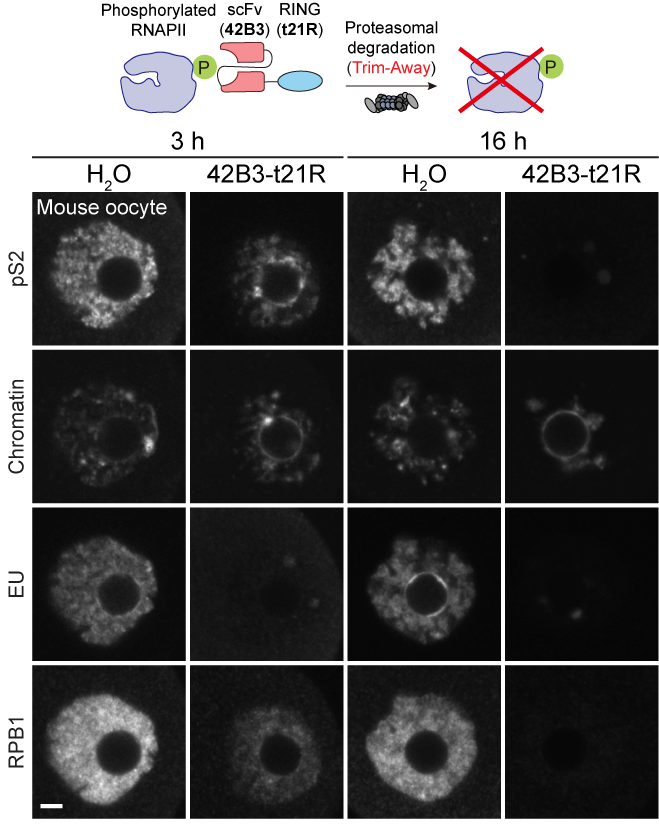
图3.利用新开发的miniTrim-Away技术降解内源RNAPII并重现NSN向SN转变的表型
为了深入解析RNAPII降解如何驱动NSN向SN转变,研究人员通过超分辨成像、CUT&Tag和磷酸酶抑制剂处理发现转录活跃的磷酸化RNAPII会积累在染色质并参与NSN向SN的转变,而不活跃的非磷酸化RNAPII会游离在核质。利用高速活细胞成像和均方位移分析,研究人员发现NSN型染色质的动态的确比SN型的低。进一步,研究人员通过过表达组蛋白H2B和锚定染色质到核膜上这两种不同限制染色质动态的方法,在功能层面上证明了约束染色质的动态可以阻止NSN向SN转变时旁染色质的凝聚。意外的是,这两种干预并不影响核仁边染色质的凝聚,说明在RNAPII降解的过程中有两种不同的作用力驱动NSN向SN转变:一种是染色质动态恢复所产生的塌陷力,而另一种可能是与核仁表面有关的吸引力。通过向核内注射核仁大小的无生物活性油滴和利用没有核仁的Npm2条件敲除小鼠,研究人员最终发现RNAPII的降解同时会引发核仁表面蛋白的重塑,并提出哺乳动物卵母细胞染色质从NSN向SN转变的完整模型(图4)。
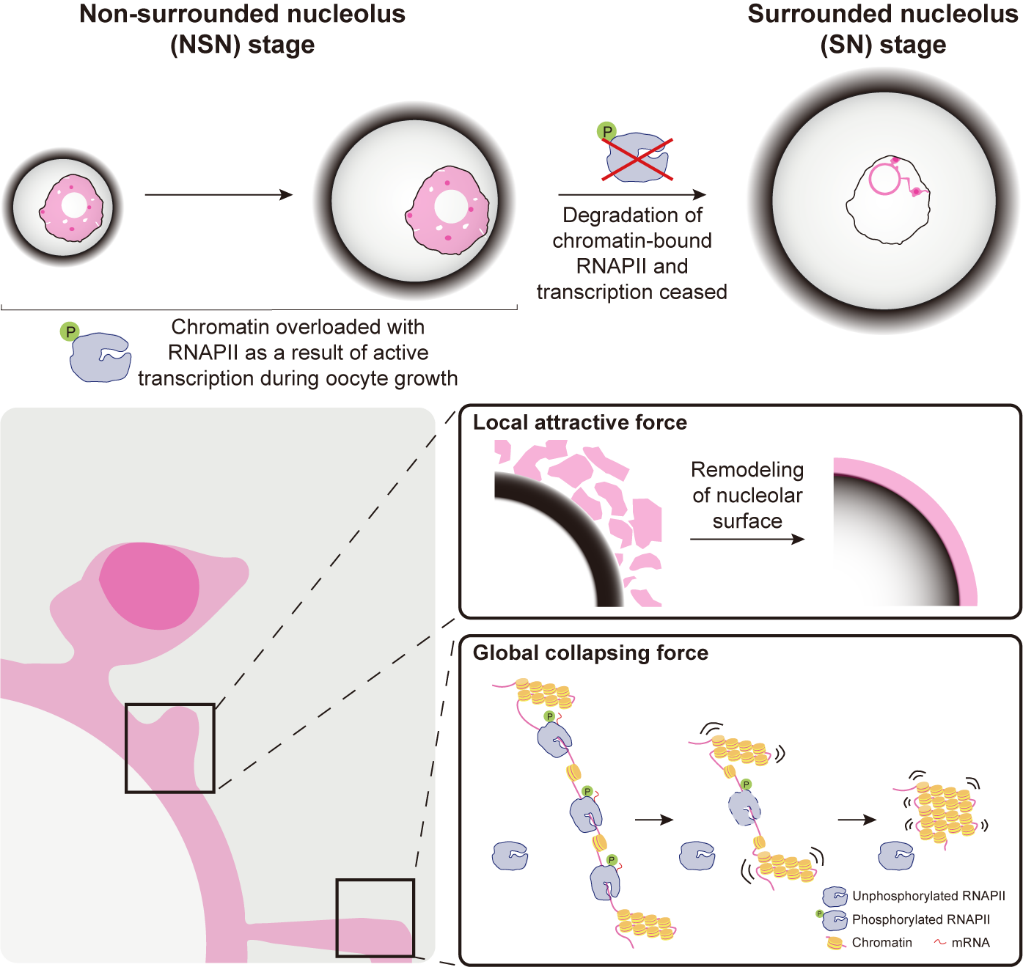
图4.研究提出的哺乳动物卵母细胞染色质成熟的机制
综上,该研究首次揭示卵母细胞染色质成熟的机制:生长过程中,RNAPII会经非经典的非泛素化依赖途径逐渐被降解。随着RNAPII从染色质上被剥离,转录终止的同时会增加染色质动态和引发核仁表面重塑,继而产生两种不同的作用力驱动NSN向SN转变。若该过程受阻,受精卵的RNAPII蛋白水平和定位会出现异常,影响母源向合子转变和后期早期胚胎发育。
清华大学生物医学交叉研究院苏俊实验室2021级博士生王静为论文第一作者,清华大学生物医学交叉研究院研究员苏俊、黎斌和中南大学基础医学院/中信湘雅生殖与遗传专科医院教授林戈为论文共同通讯作者。研究得到国家重点研发项目、北京生命科学研究所、国家自然科学基金委优秀青年科学基金项目(海外)以及阿里巴巴达摩院青橙奖等的资助。
论文链接:
https://www.nature.com/articles/s41467-025-67476-z
供稿:生物医学交叉研究院
编辑:李华山
审核:郭玲