清华新闻网12月17日电 哺乳动物大脑皮层由高度异质性的细胞谱系构成,包括神经元以及非神经元细胞。在哺乳动物大脑发育过程中,神经元与免疫细胞通过不同细胞运动模式响应环境变化,并与周围细胞发生互作。神经元的精准迁移、免疫细胞的环境监督以及神经-血管-免疫细胞间的动态互作,对于大脑皮层发育与稳态维持至关重要。
然而,传统基于急性脑切片成像的研究会破坏大脑完整性、脑内血管网络以及免疫细胞的生理静息状态,加之现有胚胎活体成像技术在观测稳定性、视角多样性和操作便捷性等方面的局限,使得在体观测胚胎小鼠大脑中神经细胞动态行为面临重大挑战。
12月16日,清华大学生命科学学院、清华-IDG/麦戈文脑科学研究院、清华-北大生命科学联合中心、膜生物学全国重点实验室米达副教授团队与清华大学医学院、清华-IDG/麦戈文脑科学研究院、清华-北大生命科学联合中心郭增才副教授团队合作,在《细胞》(Cell)发表了题为“哺乳动物发育大脑中神经元与免疫细胞动态的活体观察”(Intravital observation of neuronal and immune cell dynamics in the developing mammalian brain)的研究论文。
研究开发了一种高稳定性、多视角、长时程的胚胎小鼠宫内活体成像技术(IMEE),首次在体阐明了胚胎小鼠大脑皮层内抑制性神经元与血管网络及小胶质细胞间的动态互作模式。研究还为神经发育性疾病模型小鼠中神经元迁移异常提供了全新在体证据,同时解析了胚胎免疫细胞在响应环境压力时的动态行为模式。该工作突破了传统胚胎神经成像的技术瓶颈,为解析大脑发育过程中的神经-血管-免疫系统互作机制与协同发育机制开辟了全新的研究范式,凸显了胚胎活体成像技术在神经科学与脑疾病研究中的重要价值。
研究开发的IMEE活体成像技术,通过辅助支持装置固定胚胎小鼠并结合双光子显微成像,实现了对E10.5至E16.5胚胎小鼠的长时程、大视野、高深度活体观测。研究人员通过监测胚胎脑内血流,检查胚胎形态,评估胚胎脑组织细胞活性、组成及细胞功能等多方面指标,证实了IMEE成像过程中胚胎小鼠发育状态正常。
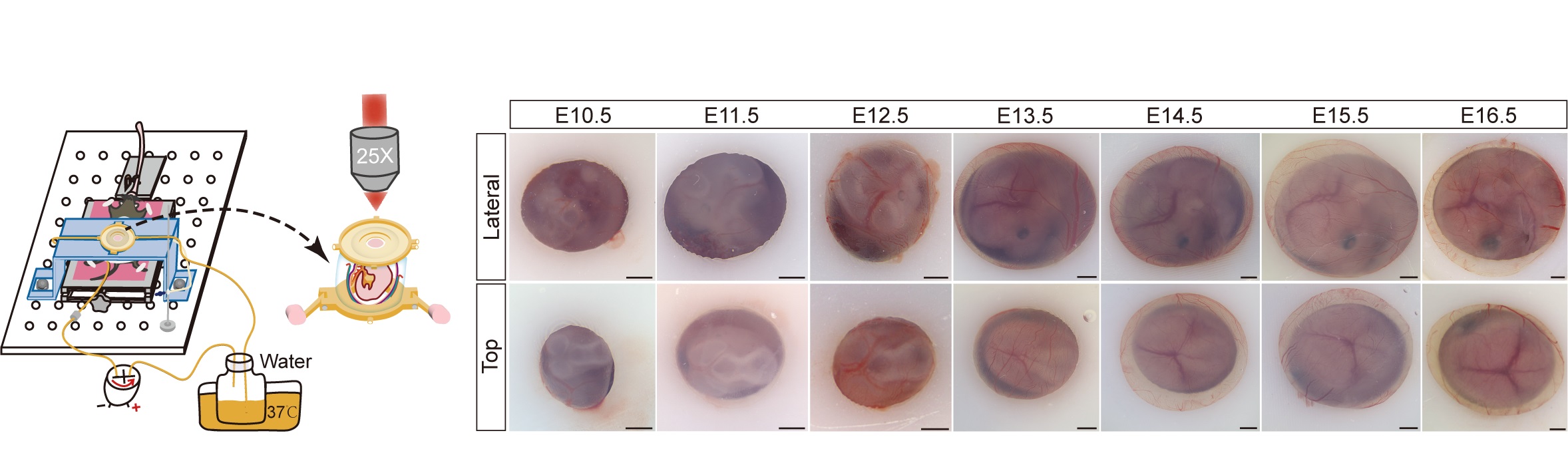
图1.IMEE活体观察不同发育时期的胚胎小鼠
利用不同品系的转基因小鼠内源荧光标记或小鼠胚胎电转技术,研究团队标记了胚胎小鼠大脑皮层内的兴奋性或抑制性神经元,并结合IMEE成像,系统性地鉴定了不同类型神经元的个体与群体迁移模式。结果显示,源于背侧端脑的新生兴奋性神经元通过多极化迁移(Multipolar migration)、位移运动(Locomotion)及胞体转运(Somal translocation)方式在大脑皮层中进行径向迁移;而产生于腹侧端脑的抑制性神经元则分别通过异质或同质方向扩散模式于皮层边缘区(Marginal zone,MZ)或脑室下区(Subventricular zone,SVZ)进行切向迁移。
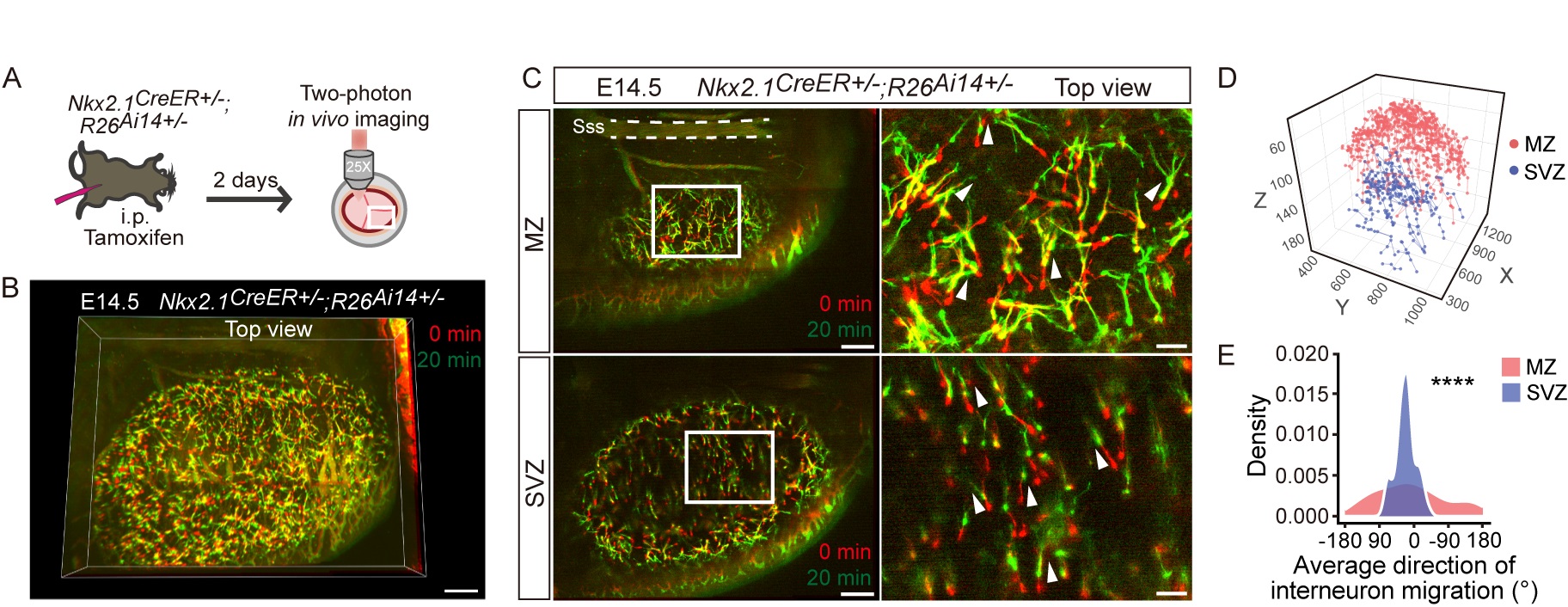
图2.胚胎小鼠大脑皮层内抑制性神经元的切向迁移
此外,借助IMEE技术,研究团队对Cx3cr1GFP+/-转基因胚胎小鼠大脑皮层中内源荧光标记的小胶质细胞进行了实时观测,并结合细胞形态变化构建向量场,进行了拓扑分解分析。结果显示,静息状态下的毛细血管相关小胶质细胞(Capillary-associated microglia, CAMs)与脑实质小胶质细胞(Parenchymal microglia, PCMs)在环境监视中表现出不同的动态行为模式,其中后者显示出更活跃的细胞突起伸缩运动。
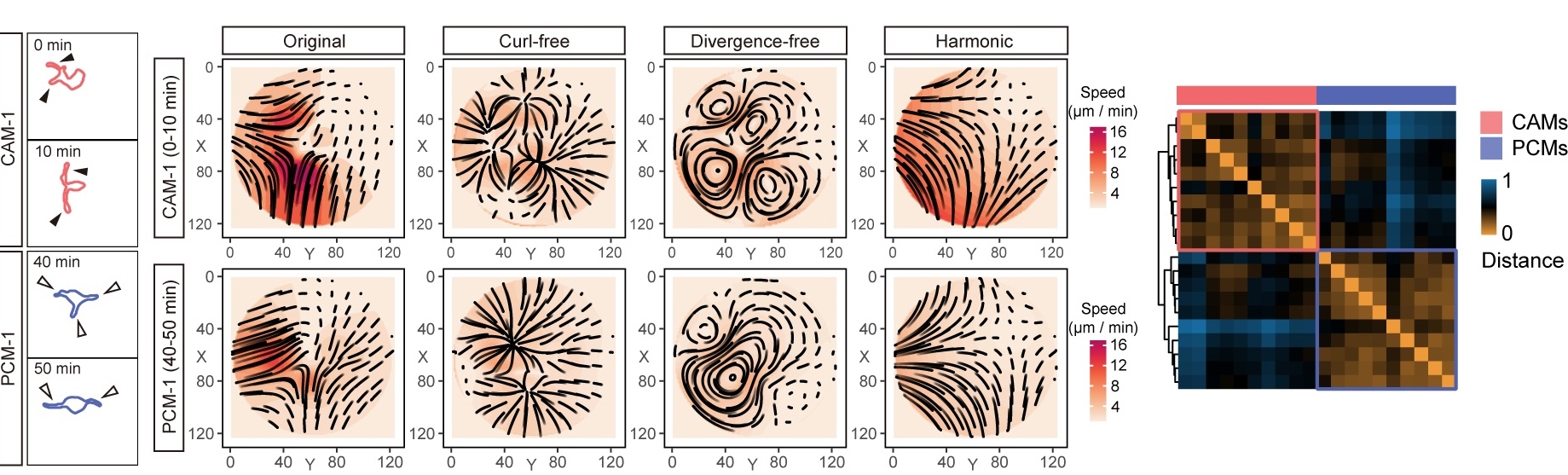
图3.胚胎小鼠大脑皮层内静息态小胶质细胞的监督行为
结合活体血管标记技术与IMEE,研究首次实现了对哺乳动物胚胎大脑内神经‑血管‑免疫互作的实时观测。根据抑制性神经元在切向迁移过程中引导突与血管的接触方式,研究团队区分出两类互作模式:末端接触(Terminal contact,TC)与突起接触(Process contact,PC)。结果表明,末端接触会引发神经元引导突分支收缩或新生,从而改变迁移路径以绕过接触对象;而突起接触则允许神经元沿原方向继续迁移,例如沿血管壁“滑动”。
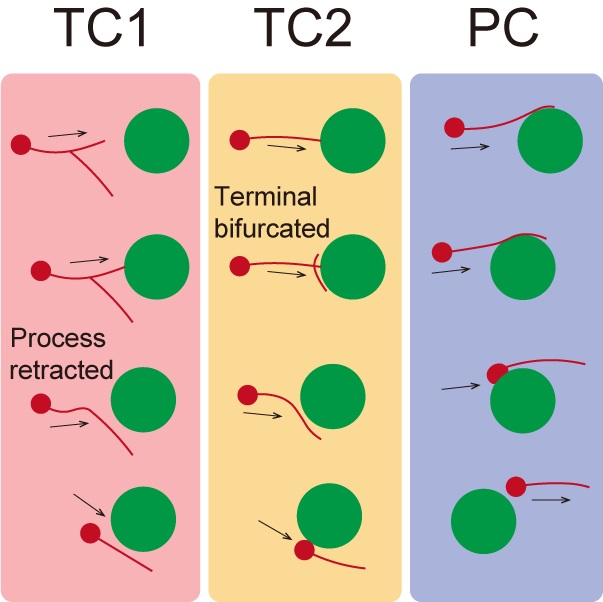
图4.抑制性神经元与血管相互作用的不同模式
此外,通过单细胞及组织转录组测序分析,研究团队解析了Eph-ephrin与Plexin-Semaphorin两类化学排斥性信号通路成员在神经元、血管内皮细胞与小胶质细胞中的表达模式与潜在细胞间通讯模式。进一步体内实验证实EphA4受体在介导中间神经元引导突末端接触血管后的排斥行为中起关键作用。
将IMEE应用于丙戊酸诱导的自闭症谱系障碍小鼠模型,研究揭示了抑制性神经元的迁移行为缺陷,将细胞动态异常与宏观发育表型直接关联,为理解此类疾病在胚胎期的病理机制提供了关键的在体证据。
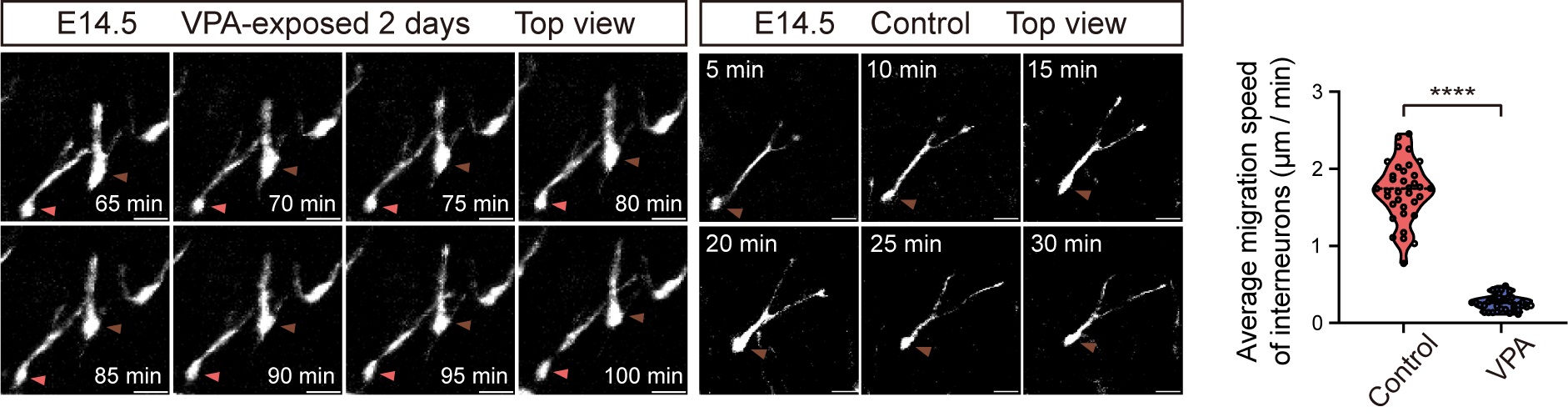
图5.抑制性神经元在自闭症谱系发育障碍小鼠模型中的迁移行为缺陷
此外,通过子宫内损伤模型结合IMEE,研究证实胚胎小胶质细胞能迅速响应损伤、聚集至受损区域,并转化为激活状态,执行吞噬与组织修复功能。
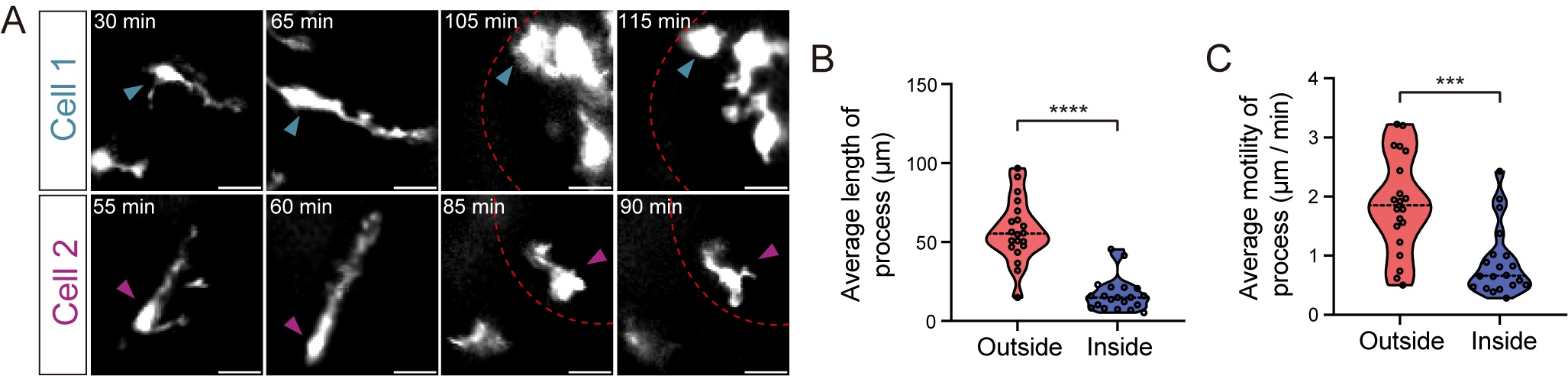
图6.胚胎小胶质细胞响应环境压力的免疫激活行为
综上,该研究综合应用新型胚胎小鼠活体成像技术IMEE、活体血管标记与向量场拓扑分析等方法,系统阐明了哺乳动物胚胎大脑内不同类型神经元与免疫细胞的动态行为,首次揭示了迁移神经元与血管网络、小胶质细胞之间的动态互作模式,并展示了病理条件下细胞行为的异常与响应。该工作为深入理解大脑发育过程中细胞对周围环境的适应机制提供了重要实验证据和理论依据,也为研究发育性脑疾病的致病机制提供了全新方法。
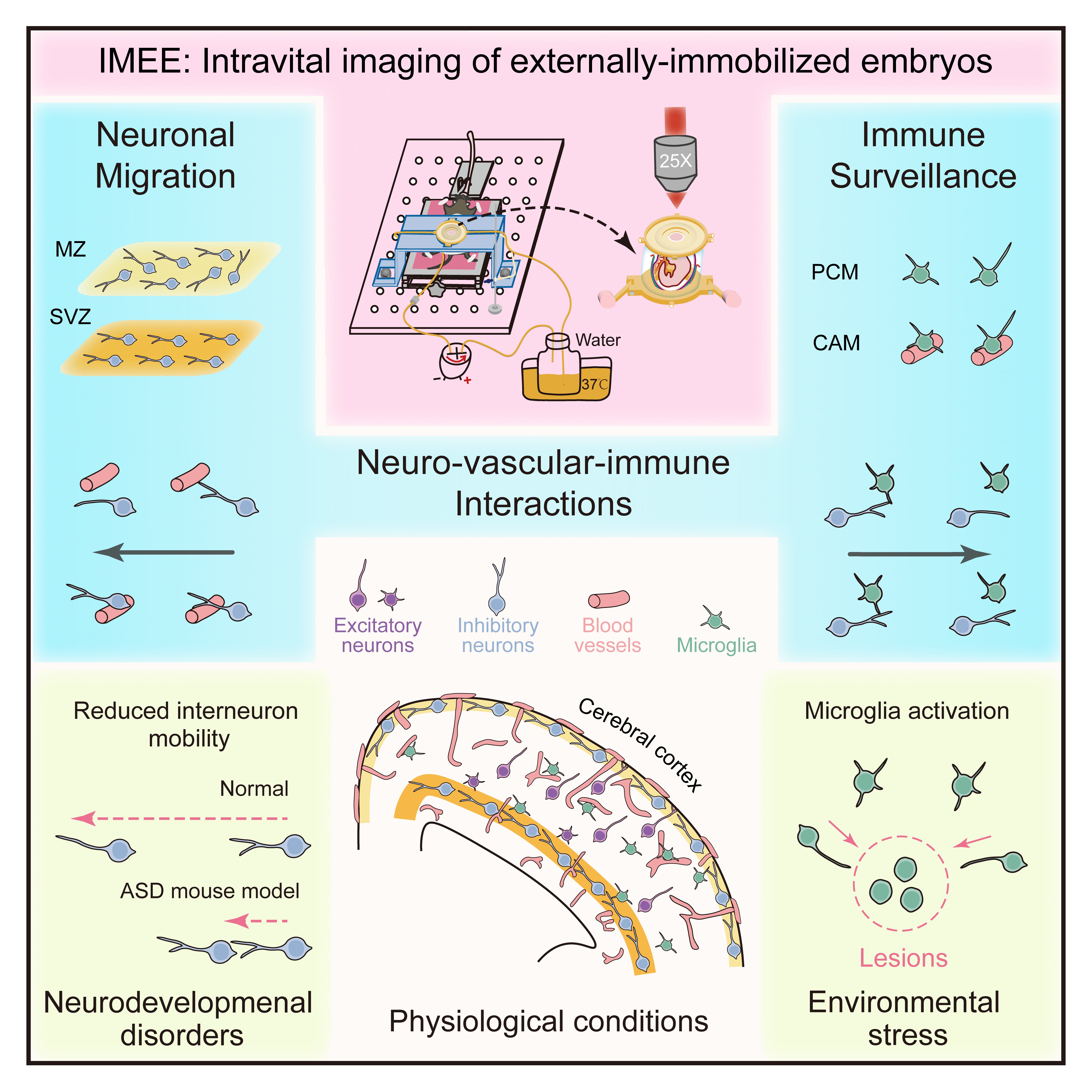
图7.研究总结图
米达与郭增才为论文共同通讯作者;清华大学生命科学学院2019级博士生龙真、医学院2017级临床医学八年制(MD/PhD)博士生于永震与生命科学学院2021级博士生贺辰祎为论文共同第一作者。研究得到国家科技创新2030“脑科学与类脑研究”重大专项、国家重点研发计划、国家自然科学基金会、膜生物学全国重点实验室、清华-北大生命科学联合中心、清华大学“笃实”专项基金等的支持。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(25)01313-3
供稿:生命学院
编辑:李华山
审核:郭玲