清华新闻网9月30日电 近期,清华大学药学院尹航教授团队揭示了核cGAS在适应性免疫中的干扰素基因刺激蛋白(STING)非依赖性作用,建立了调控调节性T细胞(Treg)介导免疫耐受的cGAS-CTCF轴。在稳态下,环状GMP-AMP合成酶(cGAS)主要位于Treg细胞核内,而在初始CD4阳性T细胞(naïve CD4⁺ T)受到刺激后,环状GMP-AMP合成酶(cGAS)的转录被激活并转位入核。通过T细胞和Treg特异性cGAS敲除小鼠实验,研究表明cGAS在胸腺阳性选择期间通过TNFRSF共刺激分子促进Treg分化,并稳定FOXP3表达。在细胞和动物层面,cGAS能够维持Treg的免疫抑制功能以及肿瘤免疫耐受。
在天然免疫细胞中,环状GMP-AMP合成酶(cGAS)是关键的胞质DNA传感器,能够识别微生物来源或异常的自身双链DNA(dsDNA)。cGAS被激活后可催化合成环状二核苷酸2'3'-cGAMP,该分子进一步结合并激活适配蛋白STING,从而启动TBK1-IRF3信号通路并诱导I型干扰素应答。有趣的是,cGAS在富含T细胞的淋巴组织中普遍表达。在CD8⁺T细胞中,cGAS可通过AKT依赖性机制维持中心记忆T细胞表型,从而增强抗肿瘤免疫。尽管CD4⁺T细胞也表达cGAS,但其DNA识别能力却主要依赖KU复合物,而非cGAS。这表明研究对cGAS在适应性免疫中,尤其是CD4⁺T细胞生物学中的功能仍缺乏完整理解。
首先,研究团队通过流式分析发现cGAS敲除鼠的胸腺和脾脏Treg数量和比例明显降低,且在与野生型骨髓的竞争性移植模型中也体现出类似的表型。进一步分析胸腺细胞亚群揭示阳性选择明显受损,而阴性选择不受影响。利用scRNA-seq结合TCR测序对Cd4CreCgasfl/fl与对照小鼠的CD4⁺CCR7⁺胸腺细胞进行转录组分析显示,这些细胞可分为13个亚群,其中调节性T细胞(Treg)前体特征性表达Tnfrsf9(4-1BB)、Tnfrsf4(OX40)及Tnfrsf18(GITR)。在cGAS缺失胸腺细胞中,FOXP3⁺Treg数量减少,成熟tTreg标志基因Nt5e(CD73)表达下降。同时,TCR信号强度报告基因Nr4a1的转录水平在Treg前体、preTreg及Treg中均显著减弱。TCR谱系分析进一步显示,cGAS缺失胸腺细胞的TCR克隆型复杂度下降,且cGAS缺失Treg群体中TCR克隆呈过度扩增,提示其多样性受损。综上,cGAS通过增强阳性选择中的TCR信号,维持tTreg分化与TCR库多样性。
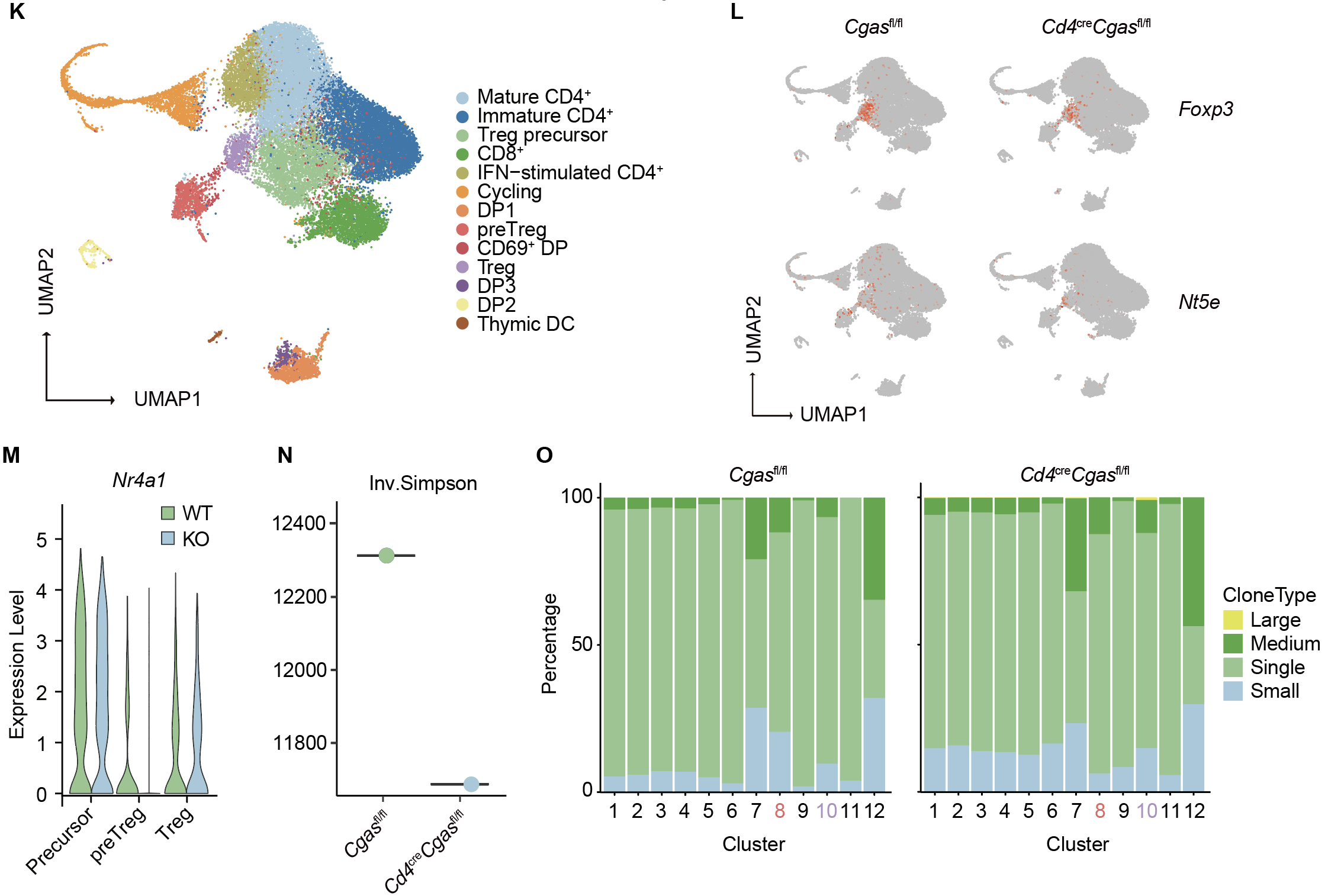
图1.CD4⁺CCR7⁺胸腺细胞的单细胞RNA测序(scRNA-seq)和T细胞受体测序(TCR-seq)分析
在胸腺正选择过程中,tTreg前体依赖高强度TCR信号与CD28共刺激诱导c-Rel表达,从而上调OX-40、GITR等TNFRSF受体基因。单细胞转录组及流式分析提示,CD69⁺OX-40⁺胸腺细胞可作为DP阶段的早期tTreg前体标志。研究发现,cGAS缺失并不影响c-Rel及ThPOK、IRF4、Helios等转录因子表达,说明CD28信号仍完整;但CD69⁺OX-40⁺比例及OX-40表达在前体阶段即下降,后续CD25、NRP1、CD73等成熟标志物亦减少,关键的CTLA-4表达亦下调。胸腺选择过程中正向信号总量决定TCR亲和力阈值及库的形成,而肿瘤坏死因子受体超家族(TNFRSF) 信号竞争对高亲和力克隆偏倚具有决定性作用。研究团队发现,体内给予4-1BB(TNFRSF9)激动性抗体可显著增加CD25⁻FOXP3lo前体比例,并挽救cGAS缺失小鼠的缺陷,同时恢复其TCR Vβ5⁺克隆比例至野生型水平。这些结果表明,cGAS通过维持TNFRSF表达和信号强度,保障tTreg的有效选择和TCR库的稳态。
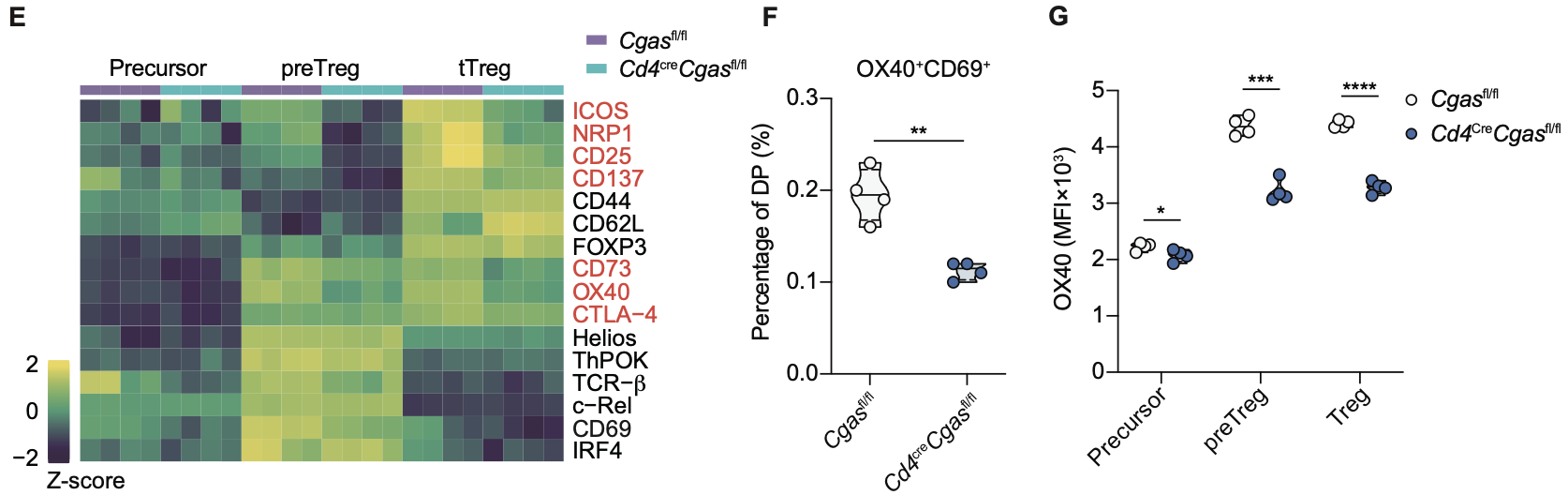
图2.T细胞cGAS条件性敲除tTreg的光谱流式分析
研究团队使用染色质可及性测序(ATAC-seq)揭示了CTCF是cGAS调控tTreg染色质可及性的关键协作因子,并证明了cGAS与CTCF存在内源性相互作用。通过in situ Hi-C和CTCF转录因子CUT&Run差异分析,研究发现cGAS维持了Treg基因组的染色质环结构,且对招募CTCF至Tnfrsf位点起到关键作用。
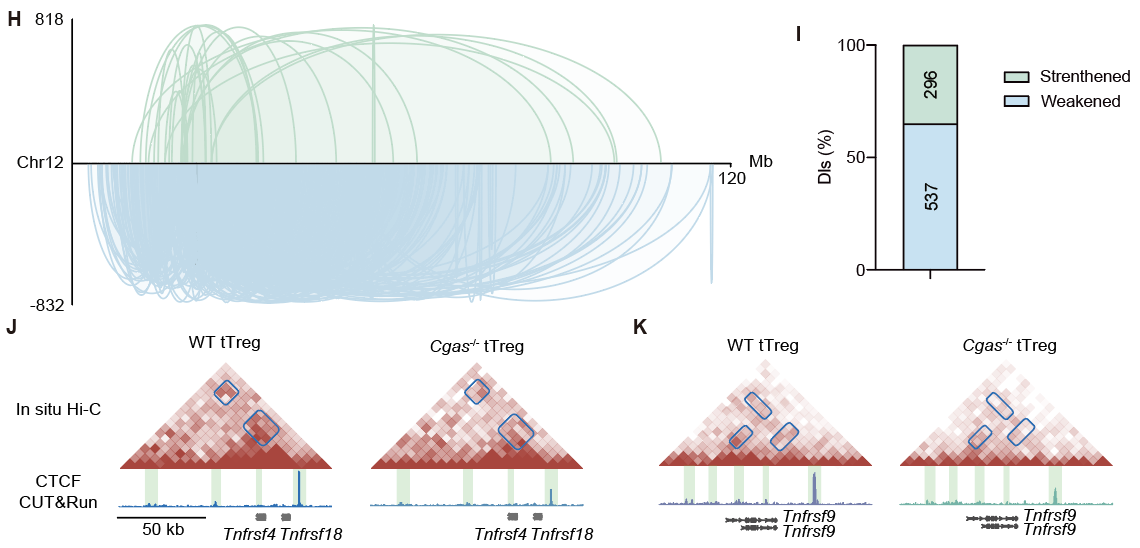
图3. 野生型和cGAS缺失tTreg的in situ Hi-C差异分析
研究团队通过体外抑制试验证明了Treg的抑制功能依赖于cGAS。在B16肿瘤模型中,Treg特异性缺失cGAS的小鼠(Foxp3Cre-YFPCgasfl/fl)表现出肿瘤体积和重量显著下降,与Treg稳定性受损的表型一致。单细胞流式分析显示,这些小鼠的肿瘤内Treg比例和数量减少,同时CD8⁺T细胞比例增加,且其中耗竭型CD8⁺T细胞(Tex)减少。这表明,cGAS不仅维持Treg的发育,还在体内外发挥关键的免疫抑制功能。
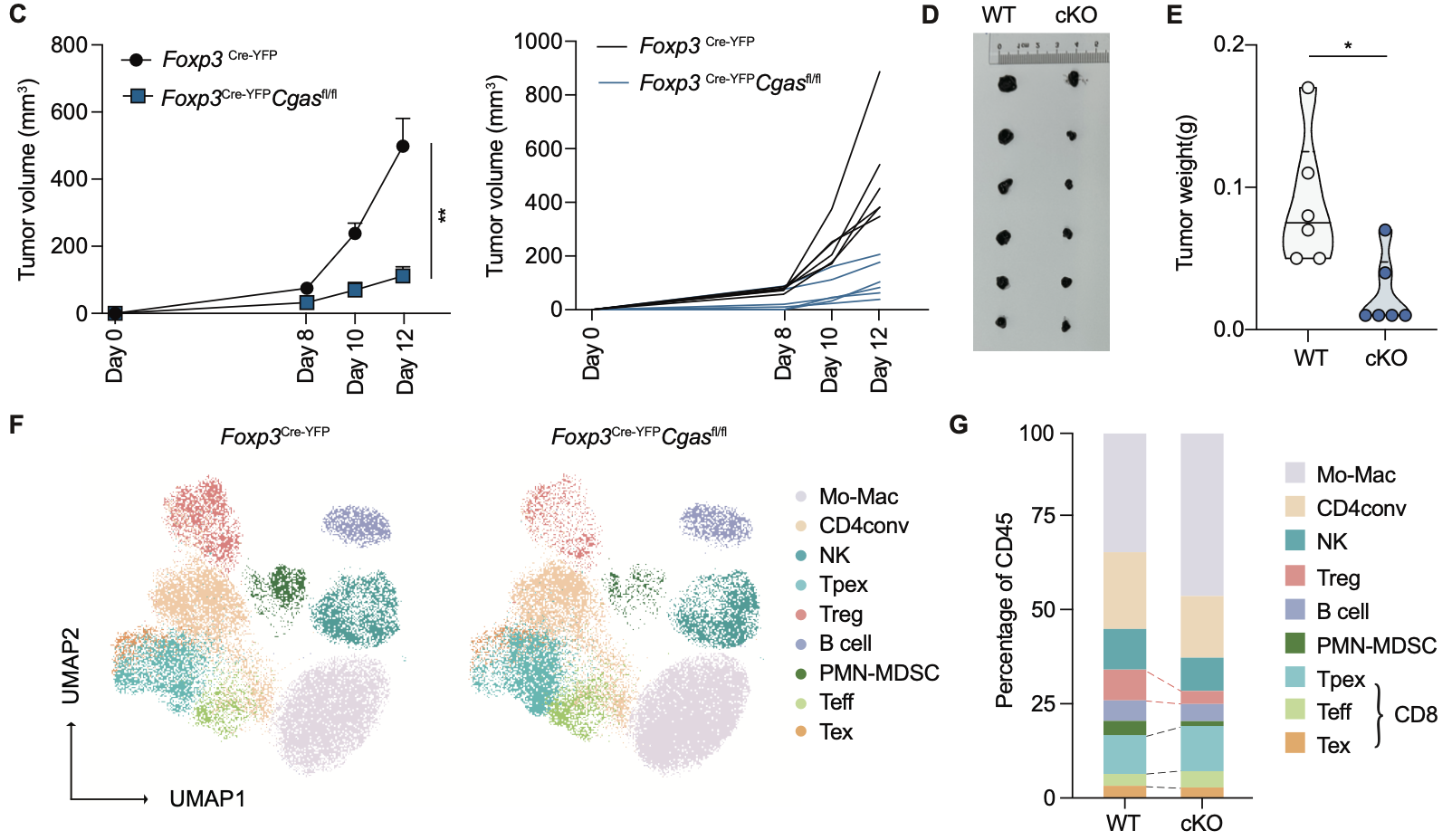
图4.野生型和Treg条件性cGAS敲除小鼠的B16肿瘤模型分析
综上,研究揭示了一种cGAS的STING非依赖性的胸腺Treg发育调控机制。cGAS与CTCF协作,通过染色质重塑调控关键共刺激受体TNFRSF9和TNFRSF4的表达。Treg特异性cGAS敲除小鼠的Treg稳定性受损,且黑色素瘤生长显著减弱。这些发现不仅拓展了对cGAS在天然免疫范畴以外的认识,也揭示了其在维持免疫耐受中的核内功能。
研究成果以“T细胞内在的cGAS-CTCF调控维持调节性T细胞的发育和功能”(T cell-intrinsic cGAS-CTCF regulation maintains regulatory T cell development and function)为题,于9月16日发表于《细胞·报道》(Cell Reports)。
清华大学医学院2022级博士生李鸿鹏为论文第一作者,清华大学药学院教授尹航为论文通讯作者。
论文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(25)01073-3
供稿:药学院
编辑:李华山
审核:郭玲