清华新闻网4月30日电 类泛素蛋白(ubiquitin-like proteins, UBLs)与泛素均源自一个古老的蛋白质家族,具有特征性的β-grasp折叠。泛素化修饰经胰蛋白酶消化后,在修饰位点仅留下两个甘氨酸残基,因此可以当做翻译后修饰采用常规质谱方法进行鉴定。与之不同,大多数UBL修饰经胰蛋白酶消化后在修饰位点留下的肽段过长,导致常规质谱方法的鉴定效果不佳。此外,有一种UBL(ATG8)不修饰蛋白,而是修饰磷脂酰乙醇胺。目前尚不清楚其他UBL是否也能修饰蛋白质以外的底物。
清华大学生物医学交叉研究院的董梦秋实验室和杜立林实验室与中国科学院计算技术研究所贺思敏研究员领导的pFind团队合作,以“泛素样蛋白(UBLs)的蛋白质和小分子底物的全局分析”(Global analysis of protein and small-molecule substrates of ubiquitin-like proteins)为题,于4月18日在《分子与细胞蛋白质组学》(Molecular & Cellular Proteomics)发表了研究论文。
研究人员以不对UBL蛋白序列进行突变为前提,在交联肽段搜索引擎pLink的基础上开发了pLink-UBL,专门用于鉴定UBL在底物蛋白上的修饰位点。以pLink-UBL为核心技术的质谱分析方法将UBL修饰视为内源性蛋白质交联,经蛋白酶酶切后产生特征性交联肽段对。其中,一条肽段来自UBL的C-末端,序列已知;另一条来自底物蛋白,含有一个被UBL修饰的赖氨酸残基,序列未知(图1)。pLink-UBL利用该特征以及对UBL修饰肽段的碎裂规律的把握,实现了快速、精准、灵敏的UBL修饰鉴定,与其他软件相比展现出明显的性能优势。
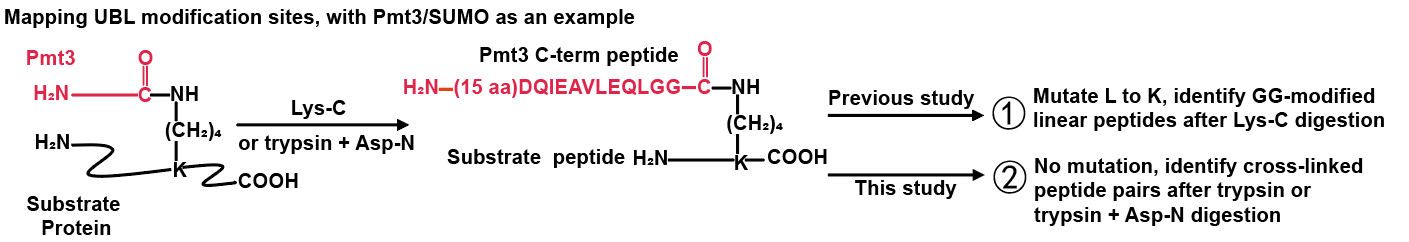
图1.类泛素修饰位点的鉴定流程
研究团队利用单肽搜索引擎pFind3能够寻找未知修饰的特长(blindsearch mode),结合抗体富集SUMO蛋白C-端多肽,开发了鉴定SUMO小分子底物的质谱方法,并在裂殖酵母中发现多胺类分子亚精胺(spermidine)是主要的SUMO小分子底物。团队在小鼠和人源质谱数据中也发现了SUMO-亚精胺共价连接体的存在。这是多胺类分子首次作为SUMO小分子底物被报道。
通过体外生化实验发现裂殖酵母SUMO(即Pmt3)与亚精胺的共价连接需要E1(Rad31/Fub2)和E2(Hus5)的催化作用,还需要ATP,但不需要E3,且SUMO与亚精胺的共价连接可以被SUMO蛋白酶Ulp1打开,因此是可逆修饰。相关生化反应总结在(图2)中。研究人员还发现泛素的E1和E2在有ATP的情况下,也能够体外催化泛素与亚精胺形成共价连接。
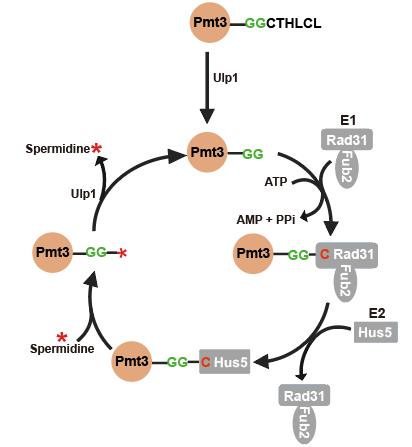
图2.SUMO修饰亚精胺(Spermidine)的分子机制模型
综上所述,该研究开发了两套鉴定类泛素修饰的质谱方法,分别针对蛋白质和小分子底物,并发现SUMO可以共价可逆修饰亚精胺(图3)。
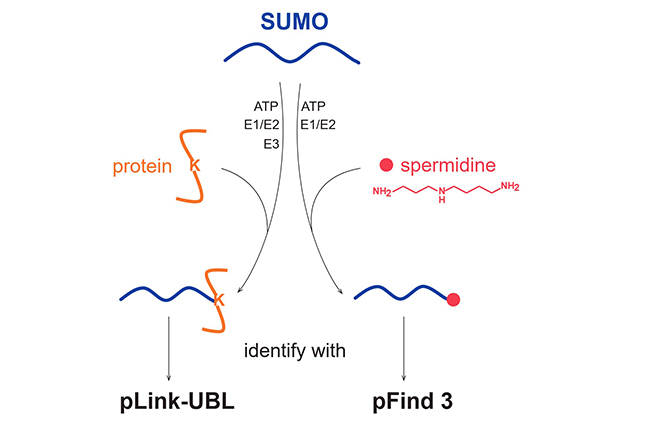
图3.SUMO修饰底物蛋白和小分子底物亚精胺的催化条件及质谱鉴定软件
董梦秋、杜立林实验室联合培养的邵光灿博士,贺思敏课题组的陈镇霖博士为论文共同第一作者。贺思敏、杜立林和董梦秋为论文共同通讯作者。其他作者包括董梦秋实验室已毕业的博士生卢珊,清华大学生物医学交叉研究院化学中心的吴青翠和齐湘兵研究员,抗体中心的盛瑶、王静和隋建华研究员,代谢中心主任马燕,以及中国科学院计算技术研究所的迟浩研究员。
该研究由国家自然科学基金委、北京生命科学研究所和清华大学生物医学交叉研究院资助,在北京生命科学研究所与中国科学院计算技术研究所完成。
论文链接:
https://doi.org/10.1016/j.mcpro.2025.100975
供稿:生物医学交叉研究院
编辑:李华山
审核:郭玲