清华新闻网12月11日电 蛋白质分泌是细胞间信息传递的核心机制之一,尤其在免疫应答和肿瘤微环境中发挥关键作用。然而,现有的探针标记等传统蛋白质组学方法虽能解析细胞内修饰状态,却无法追踪PTM蛋白是否被分泌、何时被分泌以及通过何种途径分泌。而目前的邻近标记技术仅能追踪蛋白质分泌,却无法区分不同修饰形式的蛋白质,限制了人们对PTM在细胞通讯中功能的理解。因此,亟需发展能够实现PTM特异性分泌蛋白时空解析的新方法。
近日,清华大学药学院秦为助理教授课题组与中国药科大学庄申甜副教授团队合作研究了一种名为“PTM-based secretome profiling(PBSP)”的新型化学蛋白质组学技术,实现了对携带特定翻译后修饰的分泌蛋白的时空动态追踪,并揭示了衣康酸修饰通过激活酪氨酸激酶FYN调控细胞间通讯的新机制。
PBSP的核心设计基于“脉冲-追踪”策略:研究人员首先利用带有生物正交基团的探针(如衣康酸探针ITalk)对活细胞内的蛋白进行脉冲标记,随后洗去探针并进行一段时间的追踪培养,最后从培养基中富集被标记的分泌蛋白质并进行鉴定。该方法结合了基于C18 tip的低损耗富集纯化技术(FISAP)与数据非依赖采集(DIA)质谱策略,显著提高了检测灵敏度与覆盖度(图1)。该技术不仅具备高时空分辨率,还可适配多种PTM类型,包括糖基化、羰基化、琥珀酸化等。
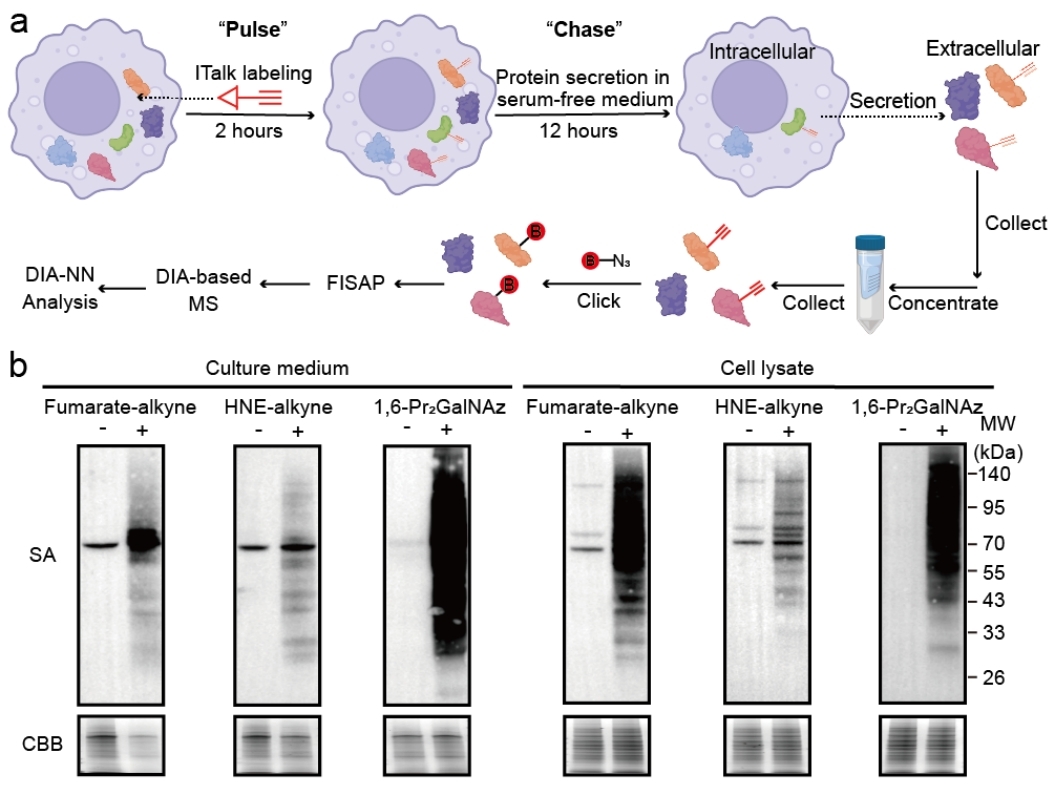
图1.(a)PBSP技术流程示意图; (b)PBSP在多种PTM分泌蛋白检测中的应用
研究团队首先将PBSP应用于巨噬细胞中的衣康酸修饰(itaconation)研究,成功鉴定出818个衣康酸修饰的分泌蛋白,其中447个为外泌体依赖性分泌。进一步分析发现,多个已知衣康酸底物(如GSDMD、KEAP1)以外泌体形式分泌,提示其在细胞间传递调控信号的可能性。
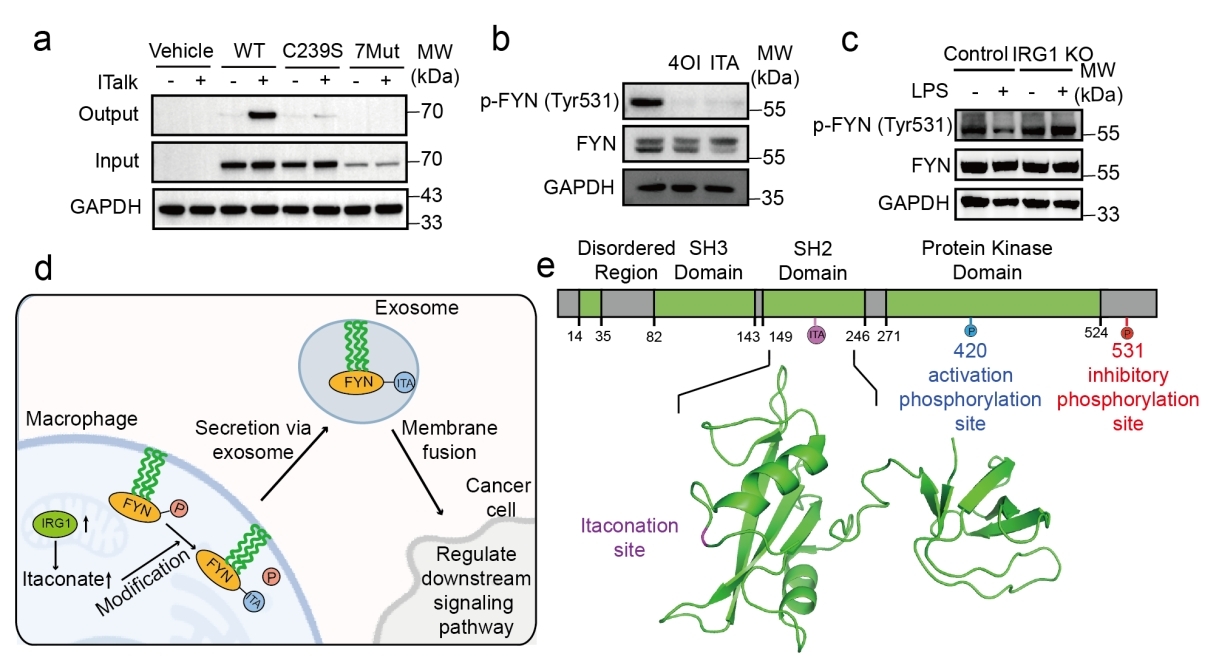
图2. FYN激酶在Cys239位点的衣康酸修饰增强其活性
尤为引人注目的是,研究团队发现酪氨酸激酶FYN在Cys239位点发生衣康酸修饰,该修饰通过抑制其Tyr531位点的磷酸化,显著增强FYN激酶活性(图2)。在IRG1敲除细胞中,LPS无法抑制FYN磷酸化,证明该调控依赖于内源性衣康酸。此外,FYN被发现存在于巨噬细胞来源的外泌体中,提示其可能通过外泌体介导的跨细胞信号传递,在肿瘤微环境等病理条件下调控受体细胞的信号通路。
此外,研究还展示了PBSP平台的可拓展性,通过替换不同PTM探针(如富马酸探针、糖基化探针等),成功实现了对多种PTM特异性分泌蛋白的系统性解析。
综上,PBSP首次实现了对PTM特异性分泌蛋白组的时空动态解析,突破了传统分泌组学技术在PTM分辨能力上的限制。该技术不仅为理解代谢物调控的蛋白质分泌与细胞间通讯提供了新工具,也为免疫调节、肿瘤微环境等研究领域提供了全新的分子视角。
研究成果以“修饰特异的分泌蛋白时空分析揭示了衣康酸化激活的酪氨酸激酶”(Spatiotemporal profiling of modification-specific proteome secretion uncovers an itaconation-activated tyrosine kinase)为题,于12月4日发表于《自然·通讯》(Nature Communications)。
清华大学药学院助理教授秦为与中国药科大学副教授庄申甜为论文共同通讯作者,秦为课题组科研助理陆文捷和博士后张艳玲为论文第一作者。研究得到国家高层次海外人才计划、国家重点研发计划青年科学家项目、国家自然科学基金重大研究计划培育项目、北京市自然科学基金青年科学基金重点项目、清华-北大生命科学联合中心、清华大学笃实计划、北京生物结构前沿研究中心、北京分子科学国家研究中心开放课题基金、深圳市医学研究基金等的支持。
论文链接:
https://www.nature.com/articles/s41467-025-66508-y
供稿:药学院
编辑:李华山
审核:郭玲