清华新闻网12月11日电 21世纪以来,肿瘤免疫治疗迎来重大突破,已经成为癌症治疗体系中不可或缺的一部分,并持续为患者带来新的希望。然而,临床应用中,仍有大量的患者不能在肿瘤免疫检查点抑制剂治疗中获益。靶向先天免疫系统被认为是提升检查点抑制剂疗效的关键方向之一,天然免疫激动剂(如TLR激动剂、STING激动剂)正逐渐成为继抗体与细胞治疗之后的重要力量。
12月10日,北京生命科学研究所/清华大学生物医学交叉研究院邵峰实验室以“胞质细菌受体ALPK1激动剂诱导抗肿瘤免疫”(Agonists for cytosolic bacterial receptor ALPK1 induce antitumour immunity)为题在《自然》(Nature)上发表研究论文。继TLR和STING激动剂后,该研究首次提出激活胞质模式识别受体ALPK1能够诱导高效的抗肿瘤免疫反应,并展示其作为免疫治疗新靶点的潜在应用价值。
研究伊始,研究团队发现,给小鼠注射ADP-Hep,或用ADP-Hep体外处理小鼠BMDM、人PBMC细胞,均可检测到CXCL10、CCL2等多种细胞因子和趋化因子的转录上调及分泌增加。随后,研究人员在多种小鼠肿瘤模型(B16F10-OVA黑色素瘤、MC38结肠癌、Hepa1-6肝细胞癌等)中发现,瘤内注射ALPK1的天然激动剂ADP-Hep能够有效抑制肿瘤的生长。在ALPK1基因敲除(Alpk1-/-)小鼠中ADP-Hep的治疗效果完全消失,说明这一抗肿瘤效果依赖于小鼠自身的ALPK1。
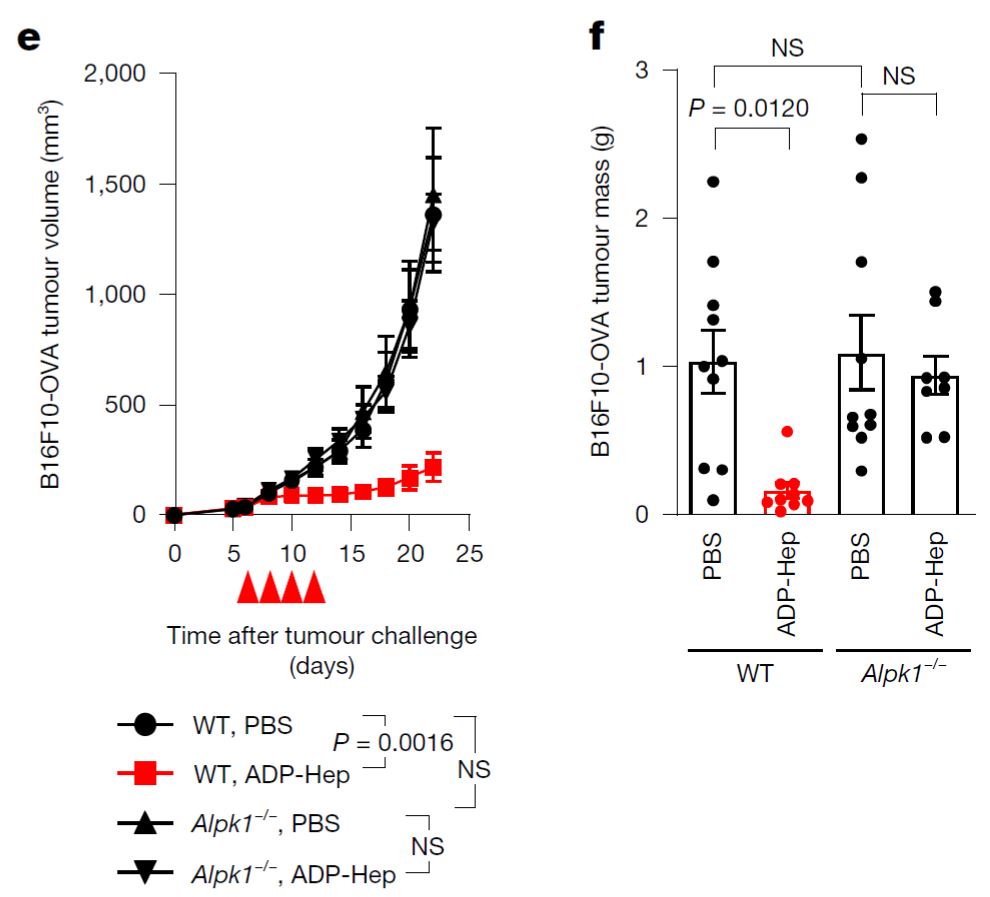
图1.ALPK1激活驱动小鼠抗肿瘤反应
然而,天然的ADP-Hep作为药物分子易被水解,稳定性不佳。为解决这些问题,研究团队设计合成了一系列ADP-Hep衍生物。其中,将腺苷替换为尿苷并引入硫代磷酸修饰的UDSP-Heptose(UDSP-Hep)脱颖而出。在体内和体外实验中,UDSP-Hep均展示了良好的稳定性和更强的生物学活性。
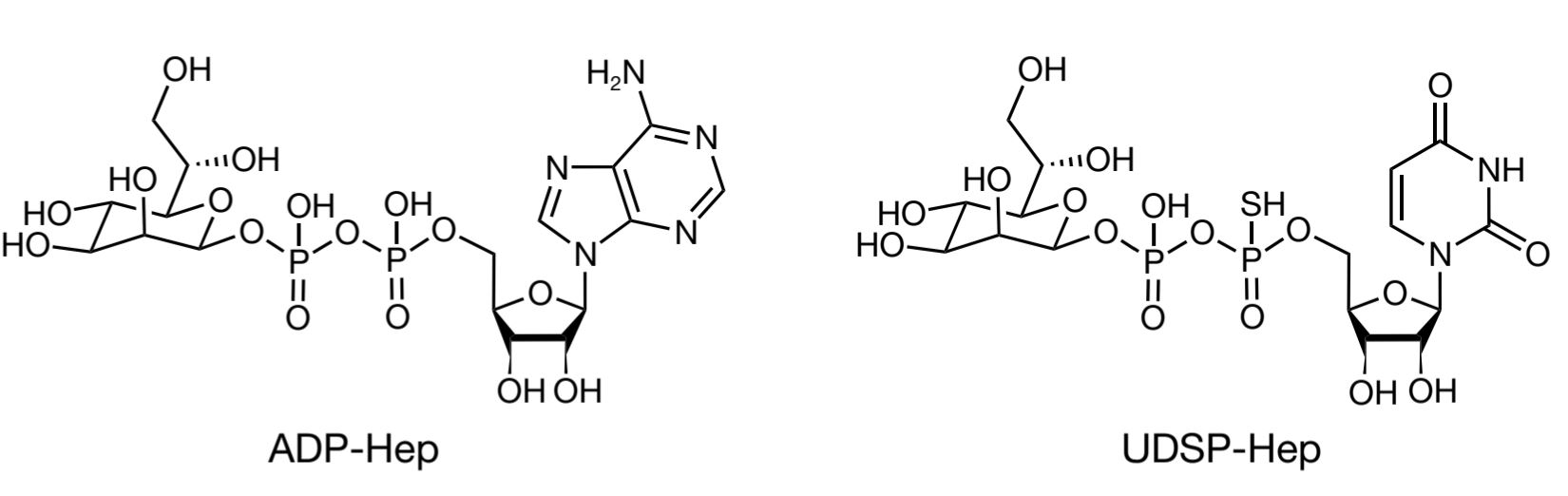
图2.ALPK1激动剂ADP-Hep与UDSP-Hep的化学结构比较
随后,研究团队使用激动活性更强的UDSP-Hep进行进一步研究。在多种皮下及原位小鼠肿瘤模型中,低剂量的UDSP-Hep即可引起肿瘤的生长抑制或清除。此外,研究还证实UDSP-Hep在ALPK1人源化小鼠模型中也有效,提示其未来应用于临床患者的潜力。
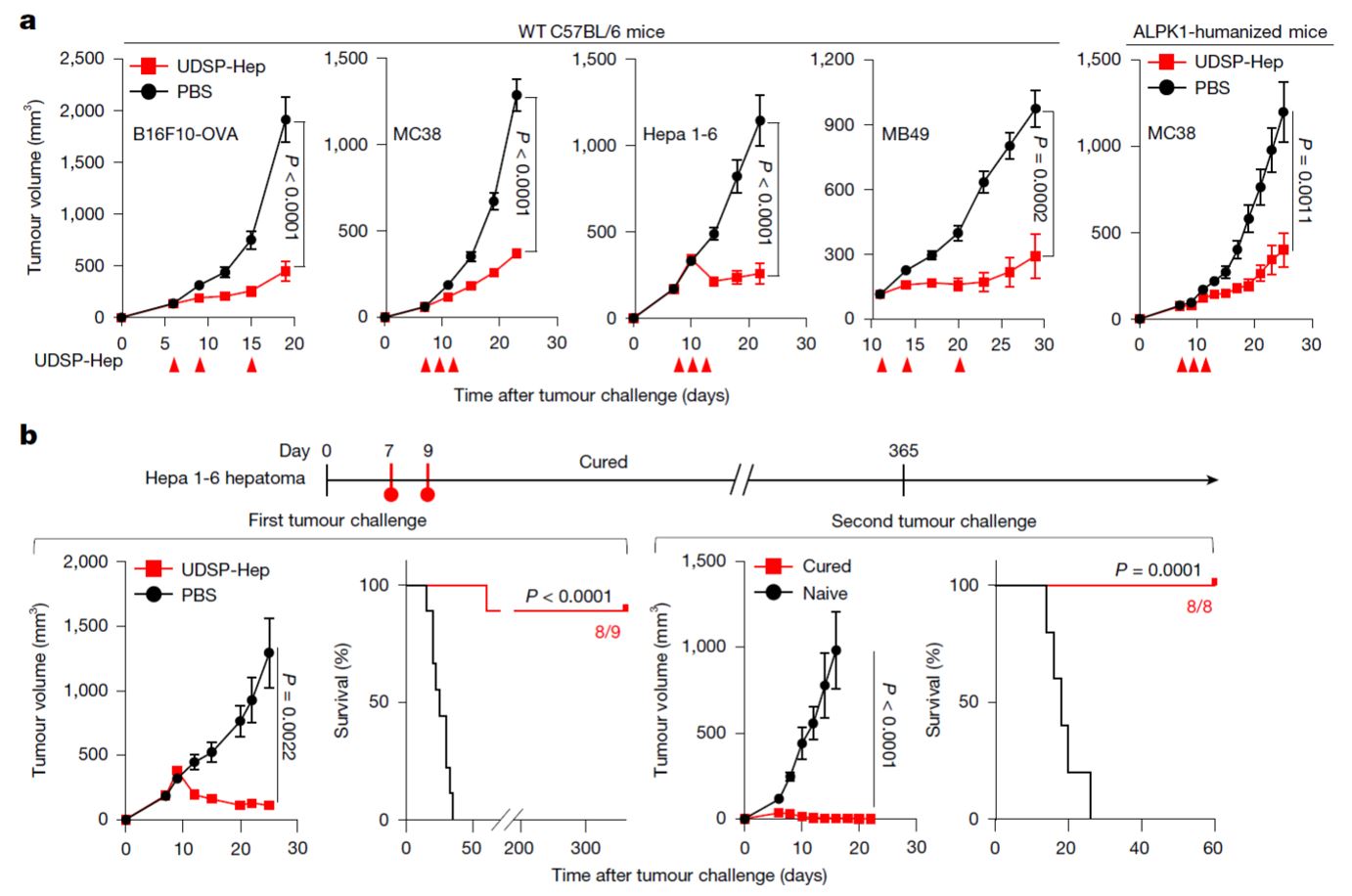
图3.ALPK1激动剂UDSP-Hep抑制肿瘤生长并诱导产生免疫记忆
为深入揭示UDSP-Hep的作用机制,研究团队进一步对肿瘤和肿瘤引流淋巴结(tdLN)进行了系统的免疫学分析和探索。抗体中和实验及基因敲除小鼠模型显示,UDSP-Hep的抗肿瘤效果依赖于CD8+T细胞、经典1型树突状细胞(cDC1s)和巨噬细胞,同时也依赖于CXCL10和CCL2两种趋化因子。骨髓移植实验表明,造血细胞的ALPK1在UDSP-Hep发挥抗肿瘤功能的时候是必须的。
机制上,UDSP-Hep能够增强cDC1对肿瘤特异性CD8+T细胞的交叉提呈和活化。UDSP-Hep处理后,cDC1s表面CD80、CD86、CD40等共刺激分子表达上调,体外实验中,低浓度的UDSP-Hep就能够激活cDC1,完成抗原提呈及对naïveCD8+T细胞活化的过程。过继性T细胞转移实验直接证明,经过UDSP-Hep治疗的小鼠肿瘤淋巴结中,肿瘤特异性CD8+T细胞具备更强的抗肿瘤能力。通过单细胞测序和流式分析技术,研究人员发现,UDSP-Hep处理后的肿瘤微环境向促炎和抗肿瘤的状态转变。尤为关键的是,UDSP-Hep治疗使肿瘤内终末耗竭(Ttex)CD8+T细胞的比例降低,同时增加了祖细胞样耗竭(Tpex)CD8+T细胞的比例,这些数据提示肿瘤浸润CD8+T细胞能够产生更强且更持续的抗肿瘤效果。
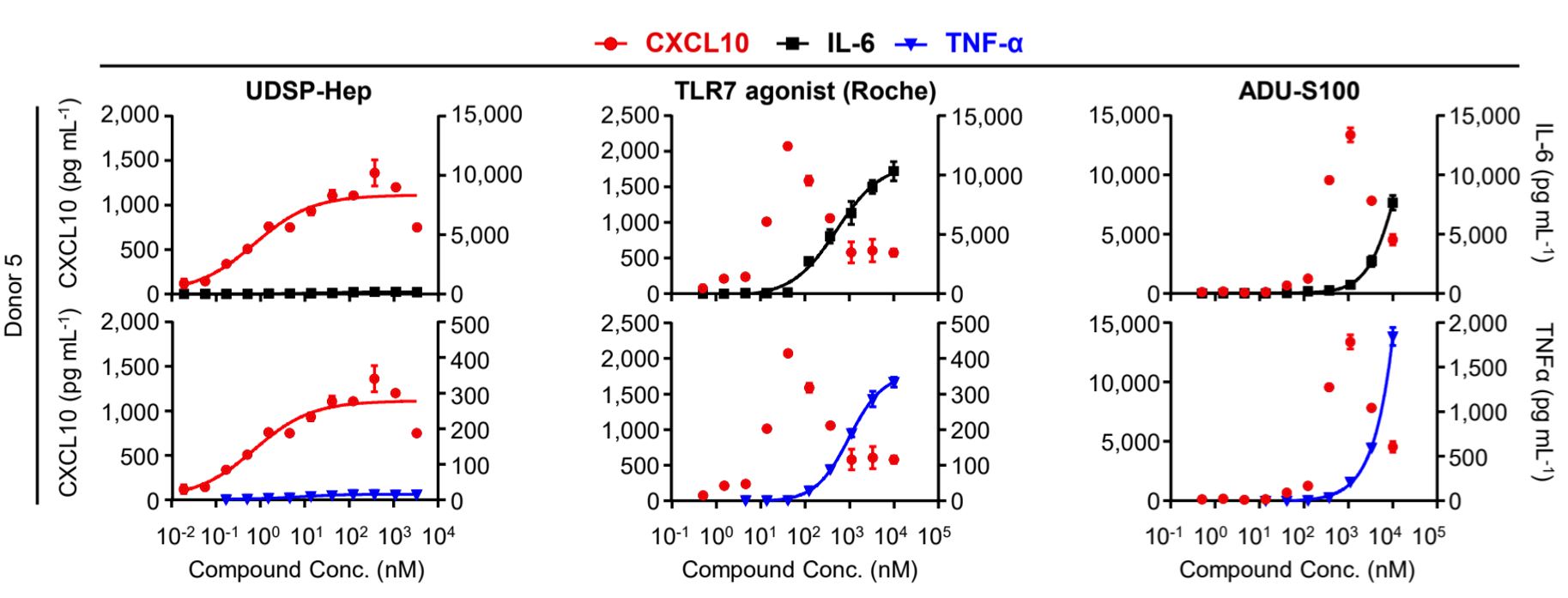
图4.UDSP-Hep诱导潜在毒性因子的能力显著低于TLR7和STING激动剂
综上所述,该研究首次系统性地研究了ALPK1信号通路在抗肿瘤免疫中的作用,并展示出ALPK1激动剂的以下特征与优势:强大的先天免疫刺激能力,促进肿瘤抗原呈递与适应性免疫激活,与检查点抑制剂协同放大疗效,有望克服STING/TLR激动剂的部分不足。这些发现为癌症免疫治疗提供了一个全新的方向。
清华大学生物医学交叉研究院教授邵峰为论文通讯作者,邵峰实验室田笑影博士和2022级博士生刘佳琪为论文第一作者。
研究得到国家重点研发计划、国家自然科学基金、中国科学院战略先导科技专项、中国医学科学院和腾讯新基石研究员等项目支持,研究在北京生命科学研究所完成。
论文链接:
https://www.nature.com/articles/s41586-025-09828-9
供稿:生物医学交叉研究院
编辑:李华山
审核:郭玲