清华新闻网6月12日电 三阴性乳腺癌(TNBC)是一种高度恶性的疾病,其典型特征是缺乏雌激素受体(ER)和孕激素受体(PR),以及人表皮生长因子受体2(HER2)无扩增。该疾病通常进展迅猛,并且容易转移至远端器官,加之缺乏特异性治疗靶点,最终因肿瘤转移导致患者生存期极短。因此,深入揭示驱动三阴性乳腺癌转移的理论机制,对于开发新的治疗策略具有至关重要的意义。
6月10日,清华大学基础医学院常智杰教授团队在《分子癌症》(Molecular Cancer)杂志在线发表了题为“CREPT通过基于协同染色质环的基因调控促进三阴性乳腺癌转移”(CREPT is required for the metastasis of triple-negative breast cancer through a co-operational-chromatin loop-based gene regulation)的研究论文。研究发现其早先克隆的一个基因CREPT是三阴性乳腺癌转移所必需的,其介导的协同染色质环增强了转移相关基因的表达,从而促进了三阴性乳腺癌的远端转移,靶向沉默后可以有效地阻断三阴性乳腺癌转移。
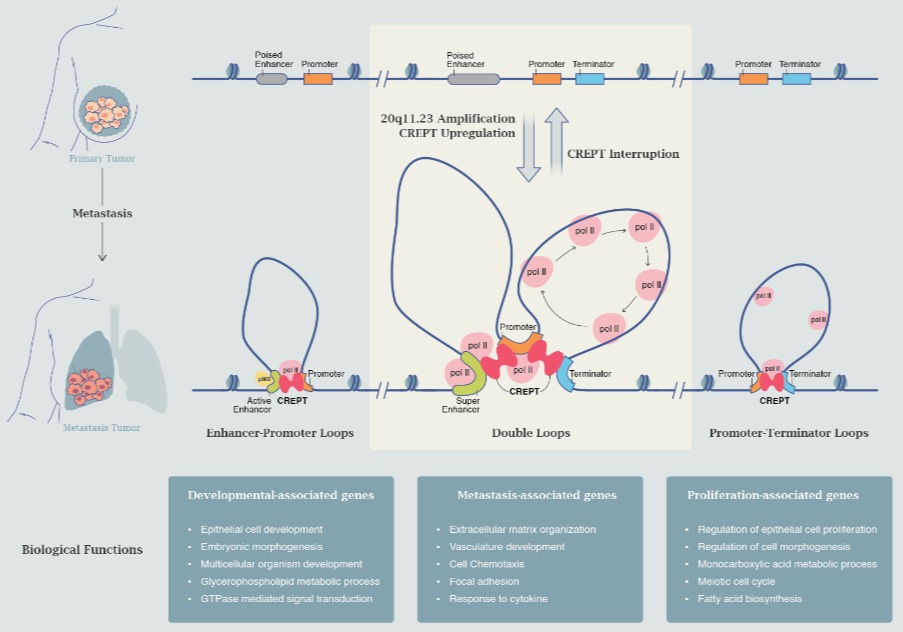
三阴性乳腺癌(TNBC)转移过程中CREPT介导的协同染色质环对转移相关基因表达调控的作用示意图
研究团队通过生物信息学的方法,发现染色体20q11.23区域拷贝数的扩增与三阴性乳腺癌转移密切相关;进一步分析表明,20q11.23拷贝数的扩增导致该区域中CREPT基因表达水平显著性上调。团队通过一系列体外和体内实验证实CREPT极大地促进了三阴性乳腺癌远端器官转移的发生。
该研究揭示CREPT是一个重要的增强子活性调控蛋白,能够结合增强子,同时也能够结合启动子。研究团队敲除CREPT后,发现增强子活性尤其是超级增强子活性显著降低。通过ChIP-MS实验,发现CREPT是通过与p300相互作用,调控增强子区域的开放性以及组蛋白H3K27的乙酰化,从而促进了增强子的活性。
研究团队发现了CREPT对染色体三维结构的维持发挥重要作用。团队通过HiC实验,发现CREPT介导了增强子和启动子与基因终止区形成一种特殊的串联双染色质环结构,称之为协同染色质环。团队利用Tn5-FISH实验,在转移相关的一些基因(如ITGA3, CCL2和MMP13)中,第一次观察到了这种双环状结构的存在。为了证明这种环状结构的功能,团队建立了一种CRISPR-dCas9靶向技术,能够干扰协同染色质环的形成,导致整个下游基因的表达受到了严重的抑制。通过多种实验,团队解析了CREPT介导协同染色质环的作用机理,提出增强子启动子环促进了靶基因启动子区RNAPII和表观遗传修饰因子的丰度,而启动子与基因终止区所形成的染色质环则会高效地促进RNAPII在启动子和转录终止区域循环利用,这种双环结构极大地促进了转录速率,实现了RNAPII“量”与“质”的高度结合,从而最大限度地促进基因表达。这一研究发现揭示了细胞中不同类型的染色质环并不是孤立地发挥调控作用,有可能是相互协同、也有可能是相互排斥。
令人振奋的是,研究团队在预防性和治疗性小鼠三阴性乳腺癌转移模型中,使用腺相关病毒AAV介导的小干扰RNA(shRNA),能够靶向沉默CREPT的表达,进而显著抑制了肿瘤细胞远端转移,极大地提高了小鼠的生存率。该研究为三阴性乳腺癌的治疗提供了新的靶点和策略,为患者的治疗带来了曙光。
清华大学基础医学院教授常智杰、金凤实验室李俊博士及清华大学基础医学院高级工程师王银银为论文共同通讯作者,基础医学院博士后李江华为论文第一作者。研究得到国家重点研发计划、国家自然科学基金、金凤实验室基金及北京市科学基金等的资助。
论文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-025-02361-3
供稿:基础医学院
编辑:李华山
图片设计:王琦鑫
审核:郭玲