清华新闻网5月19日电 近日,清华大学药学院刘翔宇课题组与沈阳药科大学无涯创新学院林斌课题组开展联合研究,通过冷冻电镜结构解析、细胞信号实验和分子动力学模拟,系统地揭示了P2Y2R激活的分子机制,涵盖了配体识别、G蛋白选择性以及由N端介导的自激活机制(图1),为后续靶向P2Y2R的药物设计和功能研究奠定了重要结构基础。
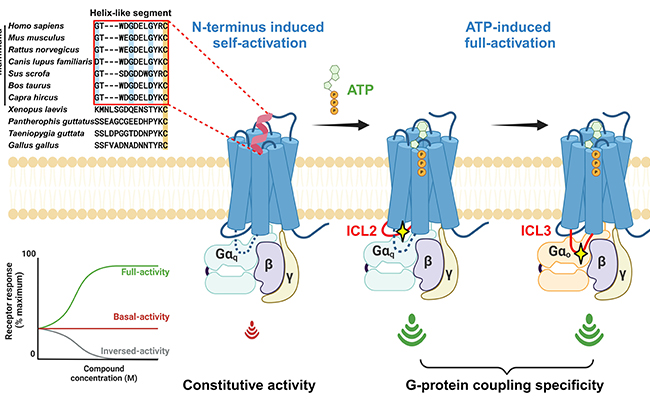
图1.P2Y2R自激活及G蛋白选择机制
ATP不仅作为生物体细胞内的“能量货币”,还充当细胞外一类重要的信号调节分子。自从1972年杰弗里·伯恩斯托克(Geoffrey Burnstock)首次提出ATP可作为细胞外信号分子后,科学家们逐渐在多种哺乳动物组织和器官中都发现了由细胞外嘌呤和嘧啶介导的信号传导现象,并认为这对于调控细胞基本生命活动具有重要意义。在已报道的嘌呤能受体中,P2Y2 receptor(P2Y2R)能够被ATP和UTP充分激活,其属于G蛋白偶联受体(简称GPCR),在调节血管舒张、离子转运、伤口愈合、炎症反应以及神经系统的发育中发挥重要作用,并且P2Y2R也作为治疗干眼症和慢性炎症疾病的有效靶点而备受关注。然而,目前关于P2Y2R的结构信息仍然缺乏,限制了我们对其配体识别和G蛋白选择性机制的理解以及基于结构的药物合理设计。
该研究中解析了三种激活态P2Y2R的冷冻电镜(Cryo-EM)结构,包括ATP激活状态下P2Y2R-Gq和P2Y2R-Go蛋白复合物,以及无配体状态下(apo state)的P2Y2R-Gq蛋白复合物的高分辨率结构(图2, 图3)。为了比较分析,研究人员还解析了同一亚家族(P2Y1-like)中与P2Y2R序列相似度最高的P2Y4R的激活态结构(图2)。
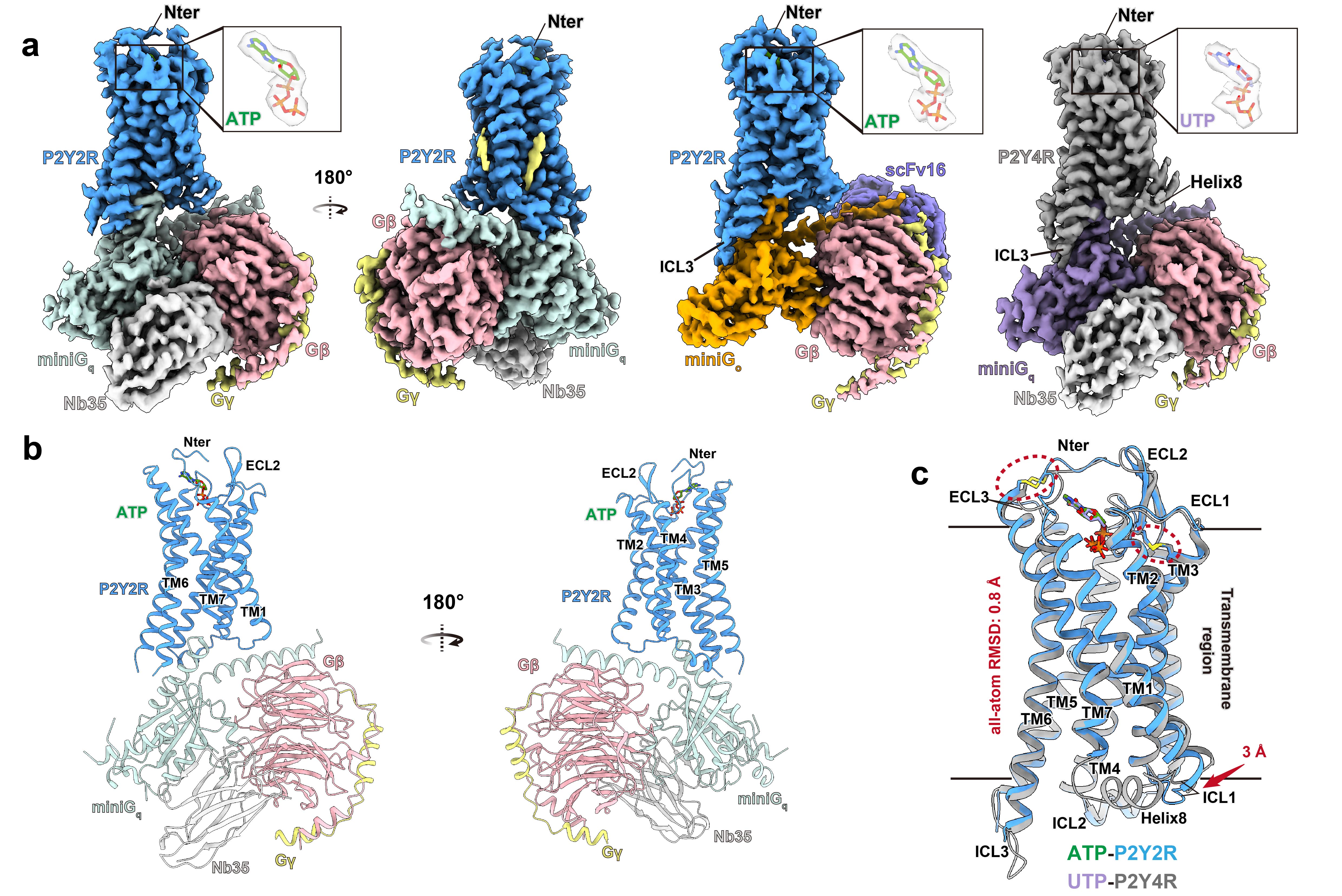
图2.ATP-P2Y2R-Gq, ATP-P2Y2R-Go和 UTP-P2Y4R-Gq复合物的冷冻电镜结构
基于结构信息,研究人员阐明了P2Y2R识别内源配体ATP的分子机理,分析了P2Y2R与其他P2Y受体在配体识别方面的共性和差异。在P2Y2R正构配体结合口袋中,ATP通过碱基朝上的方式与受体结合(图2),并且受体N端氨基酸残基的序列特异性决定了ATP优先识别P2Y2R而非P2Y4R的受体亚型选择性机制。
细胞信号分析显示,P2Y2R可以激活下游多种G蛋白亚型,其中主要包括Gq,Go,G12,G13等。结合分子动力学(MD)模拟与突变实验,研究人员阐明了P2Y2R如何通过胞内侧不同的结构元件选择性地激活特定G蛋白通路的分子机制。其中受体胞内端ICL2(Intracellular loop 2)对于Gq蛋白的激活更关键,而ICL3(Intracellular loop 3)则对于Go的激活更关键(图1)。
有趣的是,与一些A类GPCR相比,P2Y2R在没有内源性激动剂的情况下依然表现出较高的组成性激活活性。通过解析无配体结合状态下的P2Y2R和Gq蛋白复合物结构,并用突变实验和分子动力学模拟进行验证,研究人员发现了P2Y2R的一种独特激活机制:P2Y2R的N端部分序列形成helix构象并占据其正构配体结合口袋,从而引发受体自激活(图3)。进一步通过序列比对发现,P2Y2R的N端特定序列特征在大部分的哺乳动物中是保守的,并且不同于非哺乳动物,暗示了P2Y2R中的自激活现象可能与哺乳动物的复杂生理调节过程相关(图1)。
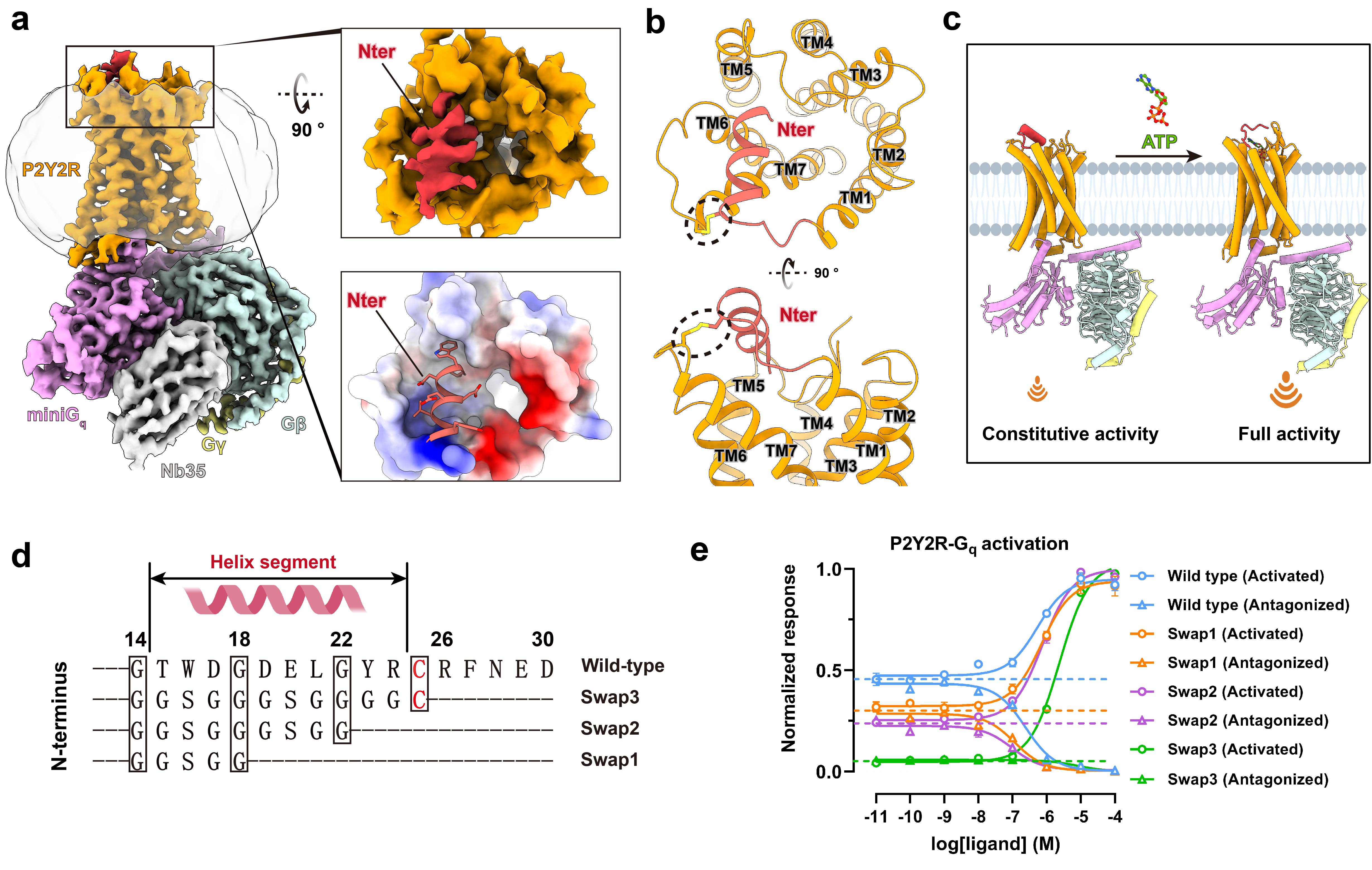
图3.P2Y2R N端诱导的受体自激活
相关研究成果以“P2Y2R自激活和G蛋白偶联分子机制的结构研究”(Structural insight into the self-activation and G-protein coupling of P2Y2 receptor)为题,于5月13日发表于《细胞发现》(Cell Discovery)。
清华大学药学院刘翔宇研究员、沈阳药科大学无涯创新学院林斌研究员为论文共同通讯作者。清华大学药学院2021级博士生蓝宝良和已毕业博士生张书豪为论文共同第一作者。研究得到国家自然科学基金委、北京生物结构前沿中心、清华大学-北京大学生命科学联合中心、清华大学自主科研计划以及沈阳药科大学中青年教师事业发展支持计划的支持。清华大学冷冻电镜平台与水木未来冷冻电镜平台为冷冻电镜数据收集提供了帮助。
论文链接:
https://www.nature.com/articles/s41421-025-00797-x?utm_source=rct_congratemailt&utm_medium=email&utm_campaign=oa_20250513&utm_content=10.1038/s41421-025-00797-x
供稿:药学院
编辑:李华山
审核:郭玲