清华新闻网5月10日电 阿尔茨海默病(AD)是一种神经退行性疾病,表现为认知功能减退以及行为与性格改变。AD具有遗传倾向,致病基因的罕见突变会直接导致常染色体显性遗传AD的发生,如APP(β-淀粉样蛋白前体)基因、PSEN1(早老素1)基因和PSEN2(早老素2)基因等。在病理层面,细胞外的β-淀粉样蛋白(Aβ)斑块沉积与细胞内的tau蛋白纤维缠结是AD的两大主要病理特征。通过遗传学研究,可以解析导致AD的关键基因以及这些基因在AD发展中的作用,对于理解AD的发病机制和开发治疗策略具有重要意义。
载脂蛋白E(APOE)基因多态性是散发性AD发生的主要遗传风险因素,与常见的APOE变体(variant)APOE*ε3相比,APOE*ε4等位基因会导致罹患AD的风险大大增加,而APOE*ε2等位基因会降低AD风险。在世界上最大的阿尔茨海默病常染色体显性遗传家系中,有一位PSEN1 E280A携带者的认知减退发生年龄推迟近30年,且脑中tau蛋白病理显著降低。全外显子测序数据揭示APOE3的罕见纯合突变APOE3 Christchurch是AD的潜在保护性因素。虽然APOE3ch突变的发现为AD的病理机制研究提供了全新视角,但是APOE3ch突变极为罕见使其无法在人源性样本中进行机制研究。
近期,清华大学药学院鲁白团队通过敲入APP基因致病性突变而建立了AD人源性类脑器官模型。该模型在时间维度依次呈现AD的关键病理特征,包括Aβ沉积、tau病理性变化、星形胶质细胞增生和神经元死亡,为研究AD发生发展机制和开发潜在的治疗靶点提供了重要工具。此外,研究人员使用该AD类脑器官模型揭示了载脂蛋白E基因APOE3ch突变对AD病理过程和神经退行性变化的保护作用(图1)。
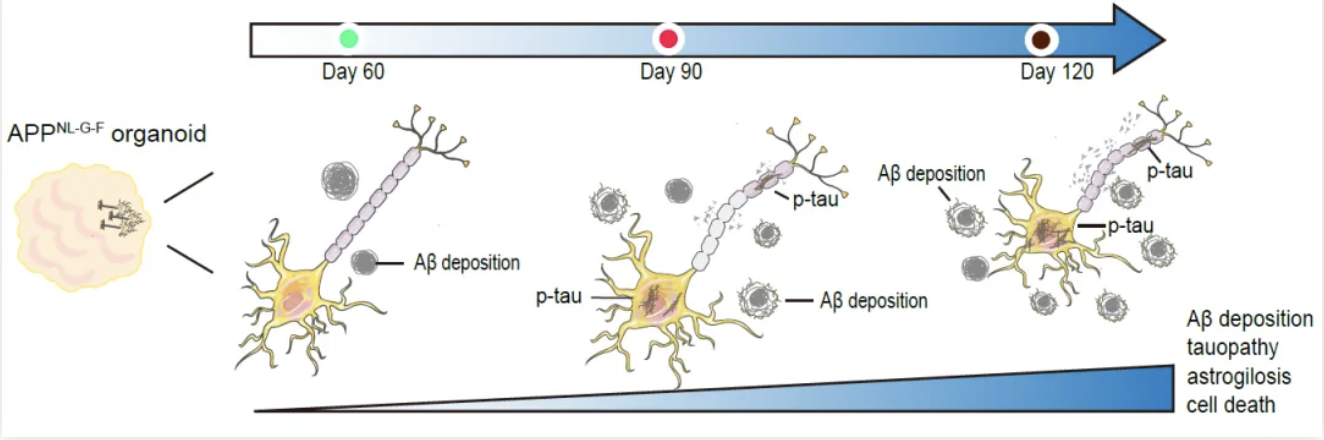
图1.APPNL-G-F人源性类脑器官模型在时间维度依次呈现AD关键病理特征
研究人员首先结合之前开发AD大鼠模型的经验,通过CRISPR-Cas9基因编辑将APP基因的3种家族遗传性致病突变引入人类H1胚胎干细胞(hESCs)中,证实了hESCs中发生了APPNL-G-F的纯合突变,并诱导分化为前脑类脑器官模型。研究人员在不同时间点检查了APPNL-G-F类脑器官模型的AD病理学特征,发现APPNL-G-F类脑器官Aβ42沉积显著增加,tau蛋白聚集增多,伴随星状胶质细胞增生。除了显著的AD病理学特征外,APPNL-G-F类器官中出现明显的细胞凋亡和坏死。
建立了人源性APPNL-G-F类脑器官模型后,研究人员利用该模型探究了APOE3ch对AD病理性变化和神经元死亡的潜在保护作用。通过CRISPR-Cas9基因编辑将APOE3ch敲入APPNL-G-FhESCs的基因组中,建立了表达APOE3(APPNL-G-F:APOE3)或APOE3ch(APPNL-G-F:APOE3ch)的AD类脑器官模型。研究人员利用上述类脑器官模型发现APOE3ch的表达显著降低了Aβ沉积,且减少了tau蛋白磷酸化和异常折叠。不仅如此, APOE3ch的表达有效缓解了APPNL-G-F类脑器官表现出的星状胶质增生和神经元死亡表型。可见,APOE3ch对于AD病理过程和神经退行性改变有显著的保护作用。
综上所述,本研究开发了一种新的人源性AD类脑器官模型(APPNL-G-F),该模型能在较短时间内高度模拟AD患者脑中出现的病理性改变及神经元死亡等特征。利用这一模型,研究人员证明了APOE3ch罕见突变对AD病理和神经退行性变的保护作用,为研究APOE3ch的生物学特点及其缓解AD的细胞和分子机制提供了新的工具。
值得一提的是,近期有两篇APOE3ch相关论文发表。在《细胞》(Cell)发表的研究中,研究者构建了人源APOE3chknock-in小鼠品系,将其与基于Aβ的APP/PS1小鼠杂交后发现,通过上调小胶质细胞的吞噬作用,APOE3ch缓解了X34+Aβ纤维聚集(非Aβ寡聚体),以及Aβ相关的tau病理特征。在《自然·神经科学》(Nature Neuroscience)发表的研究中,研究者将APOE3chknock-in到APOE4小鼠中,将其与tau转基因小鼠PS19杂交后发现,纯合APOE3ch解救了APOE4驱动的tau病理和星形胶质增生等表型。
除了与这两项研究同样证明了APOE3ch对AD病理性变化的保护作用之外,本研究还有几点重要贡献。首先,与上述两项研究不同的是,本研究使用的是完全人源化的类脑器官系统。第二,APPNL-G-F类脑器官模型是基于敲入而不是致病基因突变的过表达系统,因此避免了由于转基因表达引起的潜在非生理表型。此外,本研究开发的APPNL-G-F类脑器官模型出现了Aβ和tau病理特征、星形胶质增生以及神经元的凋亡和坏死,这些特征在APP/PS1小鼠或PS19转基因小鼠中难以全部重现,避免了小鼠模型的局限性,也突显了本研究开发新的人源性AD类脑器官模型的重要意义。
相关研究以“APOE3ch在人源性阿尔茨海默病类脑器官中缓解Aβ和tau病理特征和神经退行性改变”(APOE3ch alleviates Aβ and tau pathology and neurodegeneration in the humanAPPNL-G-Fcerebral organoid model of Alzheimer’s disease)为题,于4月12日发表于《细胞研究》(Cell Research)。
清华大学药学院2015级博士生刘航(已毕业)、北京大学医学部副研究员梅帆为该论文共同第一作者,清华大学药学院教授鲁白、梅帆为该论文共同通讯作者。研究得到国家自然科学基金、人脑保护高精尖中心、北京智源人工智能研究院、北京市自然科学基金的资助。
论文链接:
https://www.nature.com/articles/s41422-024-00957-w
供稿:药学院
编辑:李华山
审核:郭玲