清华新闻网5月9日电 PROTAC(PROteolysis TArgeting Chimera,靶向蛋白降解嵌合体)技术是近年来新兴的前沿化学生物技术。其原理是通过一个异双功能小分子同时拉近目标蛋白和E3泛素连接酶之间的距离,进而诱导目标蛋白的多聚泛素化以及通过泛素-蛋白酶体途径的降解。截至目前,该技术已经成功实现了上百种靶蛋白的降解。
天然产物作为药物发现的重要来源,拥有多样的化学结构及广泛的生物学活性。通过表型筛选,科学家们能够深入地了解受天然产物影响的细胞表型、信号通路和疾病表型,但天然产物精准的靶点鉴定仍然是该领域面临的主要挑战。由于天然产物通常具有多靶点特性,并且与靶蛋白的结合力中等或偏弱,现有的靶点鉴定策略在鉴定天然产物的特定靶点时面临着一定的挑战。
目前最为主流的靶点鉴定策略是基于活性的蛋白质分析(Activity-Based Protein Profiling,ABPP)。该策略的原理是先通过小分子与靶蛋白之间形成共价键,随后通过linker引入报告基团如荧光基团或biotin,再通过凝胶荧光成像或biotin富集后的定量蛋白质组学来进行靶点鉴定。对于非共价小分子,ABPP需要外源引入光交联基团来实现共价交联。尽管该技术目前已被广泛应用于小分子药物的靶点鉴定,但它仍存在一些局限性。其高度依赖于小分子与靶蛋白之间的结合力,因此需要形成稳定的共价相互作用,而光交联基团的引入条件较为苛刻,且会产生大量的非特异性结合并对组学结果的分析造成一定的干扰。目前尚缺少一种基于非共价结合的靶点鉴定策略,而PROTAC技术的出现有望填补该空白。PROTAC的本质是小分子诱导的蛋白质互作,其不完全依赖于小分子与靶蛋白之间的结合力,理论上,弱结合靶蛋白通过PROTAC技术也能够实现高效的降解。
近期,清华大学药学院饶燏课题组结合了PROTAC技术与蛋白质组学技术,系统性地提出了全新的靶点鉴定策略——基于降解的蛋白质分析(Degradation-Based Protein Profiling,DBPP),并将其应用于中药活性成分雷公藤红素的靶点鉴定(图1)。通过使用一整套PROTAC工具箱,研究人员成功鉴定了雷公藤红素的三个已知靶点PI3Kα、IKKβ、CIP2A以及三个潜在新靶点CHK1、OGA、ERCC6L,证明了该策略的强大能力。DBPP策略是PROTAC技术在靶点鉴定领域的新应用,为解决领域内关键问题提供了新方法。
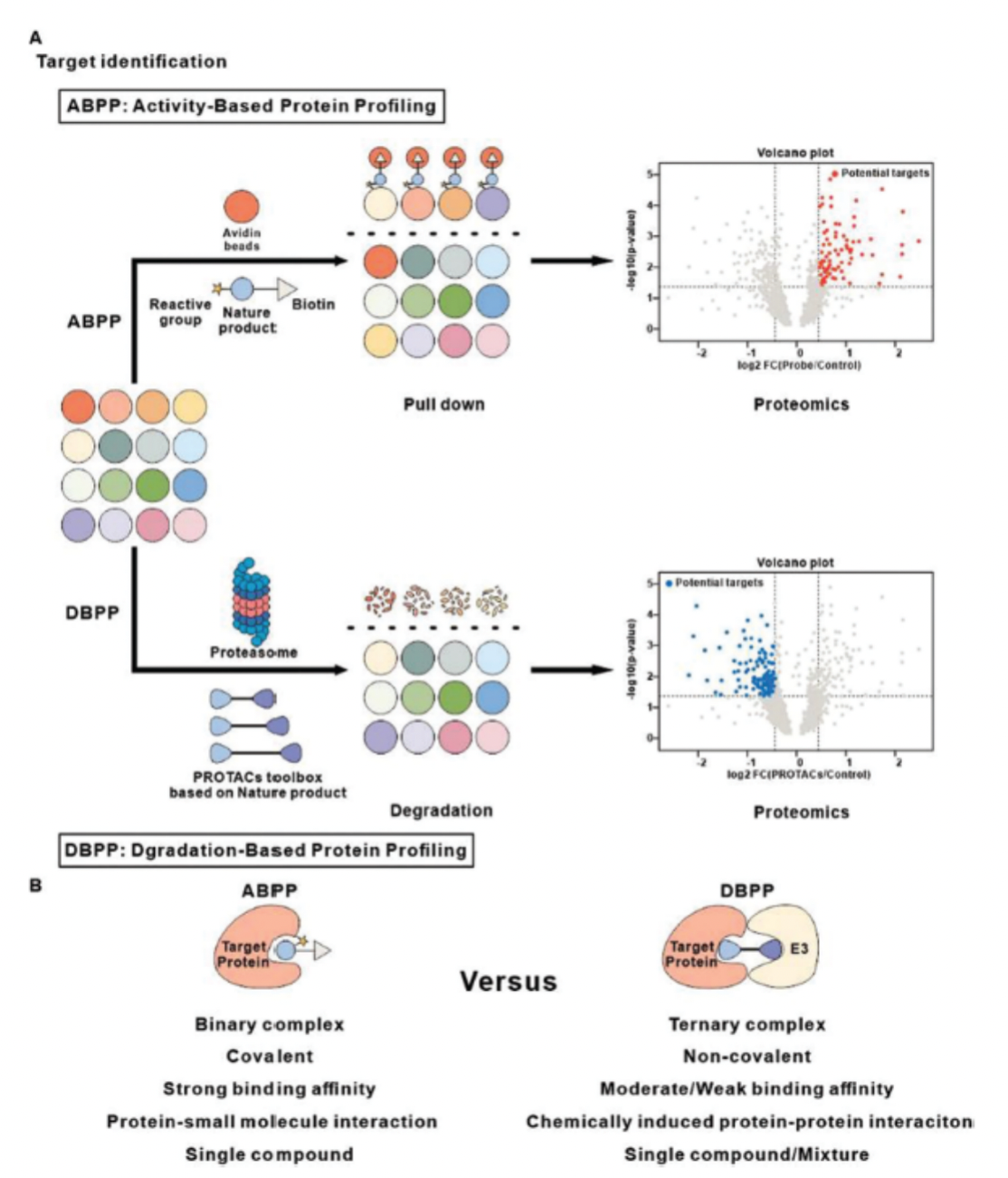
图1.ABPP与DBPP对比模式图
首先,研究人员基于雷公藤红素的构效关系研究构建了相应的PROAC化合物库(图2)。综合考虑细胞表型、linker的长度及类型等多个因素,他们挑选出由四个PROTAC分子组成的靶点鉴定工具箱。
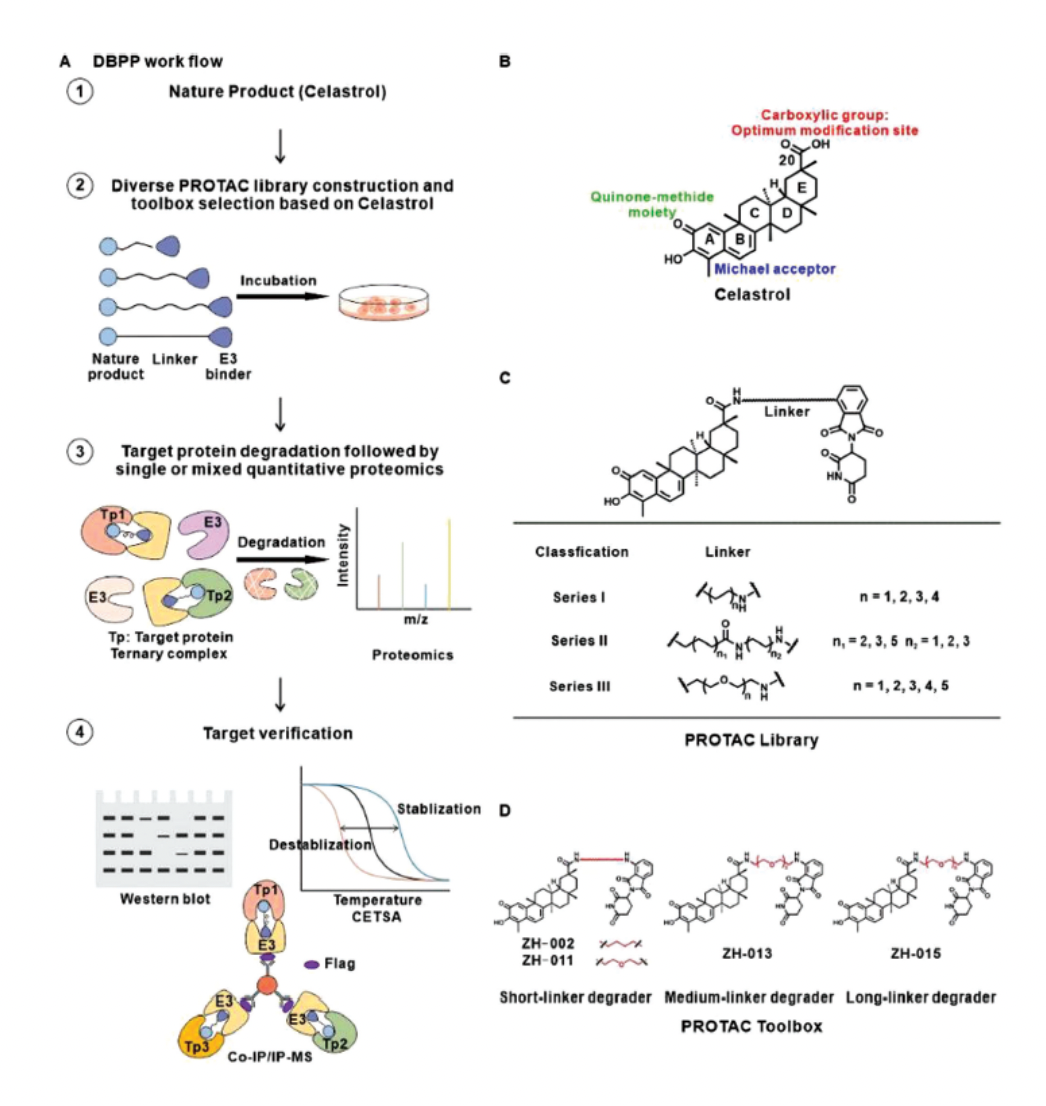
图2.PROTAC化合物库的构建及工具箱的选择
随后,他们分别对工具箱中的PROTAC分子进行了TMT标记的定量蛋白质组学实验(图3)。综合组学分析结果与雷公藤红素的生物学功能,他们初步挑选了包括PI3Kα、IKKβ、CHK1、OGA、NEK7、DCAF16在内的六个潜在靶点。通过对上述靶点的初步验证,他们进一步聚焦于PI3Kα、IKKβ、CHK1和OGA的研究。在此过程中,他们发现不同的分子对不同的靶蛋白表现出了一定程度的降解选择性,该结果与实验设计的初衷相符合。
接着,他们对上述靶点开展了进一步的验证工作。他们先通过两个已知靶点PI3Kα、IKKβ建立了一套适用于DBPP的评估体系,其中包括靶蛋白降解普适性的验证、降解机制的验证、三元复合物形成的验证以及雷公藤红素与靶蛋白之间直接相互作用的验证,并将该体系成功应用于新靶点CHK1和OGA的研究。
最后,他们对DBPP策略进行了两个方面的优化。通过综合分析降解组学和IP组学以及引入混合分子蛋白质组学的方式,他们进一步提高了该策略的效率及准确性。
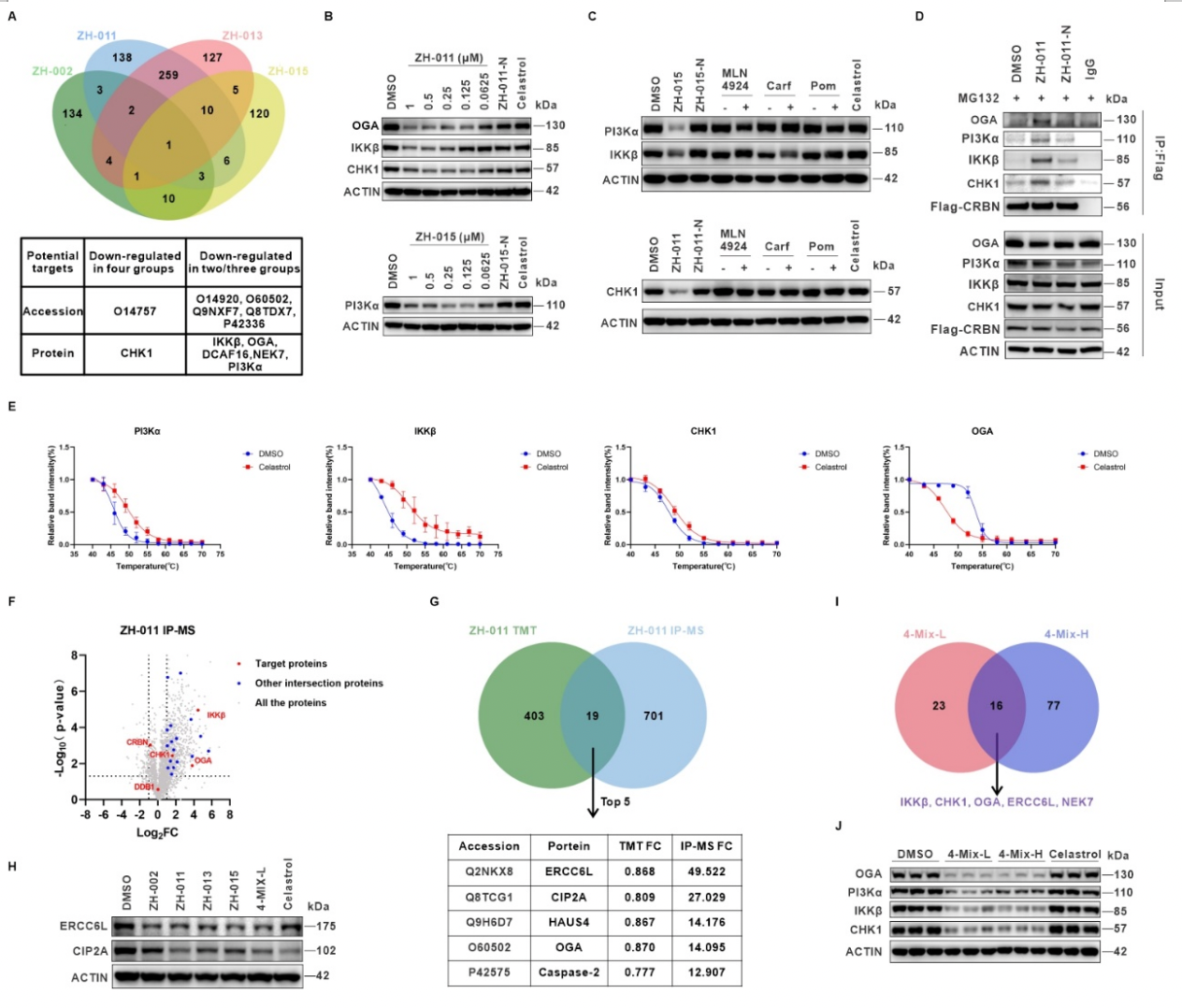
图3. 靶点验证及策略优化
综上,研究人员将PROTAC技术与多种蛋白质组学技术相结合,提出并进一步优化了DBPP非共价靶点鉴定新策略,该策略不仅适用于天然产物的靶点鉴定,还可用于现有药物分子的脱靶研究以及老药新用。通过与现有的靶点鉴定策略相互补充,DBPP策略有望推动药学相关领域的发展。
4月25日,相关研究成果以“基于降解的蛋白质分析策略:以雷公藤红素的靶点研究为例”(Degradation-Based Protein Profiling: A Case Study of Celastrol)为题,发表于《先进科学》(Advanced Science)。
清华大学药学院饶燏课题组2018级博士生倪智豪、2020级博士生施奕(CLS项目)为论文共同第一作者,清华大学药学院教授饶燏为论文通讯作者,清华大学药学院2020级博士生刘乾隆、已毕业博士王立国以及昌平实验室研究员孙秀云参与了该工作。研究得到首都医科大学教授高伟和清华大学教授邓海腾的帮助,并得到清华大学蛋白质化学与组学平台的技术支持。研究还得到中国国家自然科学基金和国家重点研发计划的大力支持。
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202308186
供稿:药学院
编辑:李华山
审核:郭玲